解题方法
1 . 如图是由常见元素组成的一些单质及其化合物之间的转化关系图。常温常压下,B、E、F、H、I均为气体,F无色无味且能使澄清石灰水变浑浊;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色。A是一种常见的肥料。C、G、K的焰色试验呈黄色(反应中生成的部分物质已略去)。
(1)物质F的化学式为______ ,D物质的电子式________ 。
(2)写出反应D→B+E 的化学方程式:_______ 。
(3)写出反应④的离子方程式:_____ 。
(4)写出反应E→H 的化学方程式,并标出电子转移的方向和数目:_____ 。
(5)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。现可以使用 或其他物质将氮氧化物还原为
或其他物质将氮氧化物还原为 。请以尾气中的
。请以尾气中的 处理为例,写出相关反应的化学方程式
处理为例,写出相关反应的化学方程式_______ 。

(1)物质F的化学式为
(2)写出反应D→B+E 的化学方程式:
(3)写出反应④的离子方程式:
(4)写出反应E→H 的化学方程式,并标出电子转移的方向和数目:
(5)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。现可以使用
 或其他物质将氮氧化物还原为
或其他物质将氮氧化物还原为 。请以尾气中的
。请以尾气中的 处理为例,写出相关反应的化学方程式
处理为例,写出相关反应的化学方程式
您最近一年使用:0次
名校
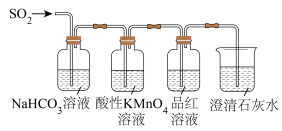
2 . 实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。_______ ,则气密性良好。
(2)装置A中反应的化学方程式为_______ 。
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有_______ (填“还原性”、“氧化性”或“漂白性”);经测定,产物中含有一种摩尔质量为104g/mol的盐,该盐的化学式为_______ 。
(4)试管D中反应的离子方程式为_______ 。
(5)实验结束时,关闭止水夹K,装置B的作用是_______ 。
(6)用图所示装置验证H2SO3酸性比H2CO3强。_______ ,Y为_______ ,Z为_______ 。
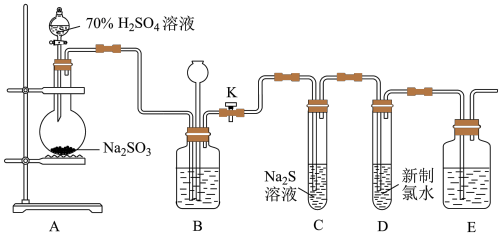
(2)装置A中反应的化学方程式为
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有
(4)试管D中反应的离子方程式为
(5)实验结束时,关闭止水夹K,装置B的作用是
(6)用图所示装置验证H2SO3酸性比H2CO3强。
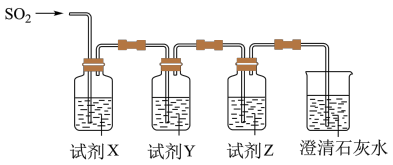
您最近一年使用:0次
名校
解题方法
3 . 某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。________ 。
(2)当观察到________ ,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知:浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
(3)上述实验中,铁丝绕成螺旋状的目的是________ 。
(4)实验1中,铁与稀硫酸反应的离子方程式为________ 。
(5)实验2中的现象常被称为________ 。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。________ ;检测装置A的溶液中含有Fe3+的试剂是_______ 。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有________ 。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。
(2)当观察到
Ⅱ.研究铁与硫酸的反应。
已知:浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
| 实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
| 2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是
(4)实验1中,铁与稀硫酸反应的离子方程式为
(5)实验2中的现象常被称为
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
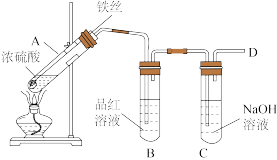
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有
您最近一年使用:0次
名校
解题方法
4 . 地球上既有辽阔的海洋也有浩瀚的沙漠。
(1)“从沙滩到用户”的关键第一步反应是利用石英砂可以制备粗硅,其反应的方程式为______ ;
(2)下图的实验装置中,在试管C中观察到凝胶状的白色沉淀。反应的化学方程式为______ 。______ 。有同学依据以上实验得出以下一些结论,其中正确的是______ (填序号)。
A.物质的酸性:
B.元素的非金属性:Cl>C>Si
C.试管B中饱和 溶液的主要作用是除去
溶液的主要作用是除去 气体中温有的HCl
气体中温有的HCl
D.在试管B中发生反应的离子方程式为:
(3)硅酸钠溶液是一种粘稠的液体,这与硅酸根离子的长键结构有关: 溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有
溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有 个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有
个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有______ 个硅氧四面体的结构单元。
(1)“从沙滩到用户”的关键第一步反应是利用石英砂可以制备粗硅,其反应的方程式为
(2)下图的实验装置中,在试管C中观察到凝胶状的白色沉淀。反应的化学方程式为

A.物质的酸性:

B.元素的非金属性:Cl>C>Si
C.试管B中饱和
 溶液的主要作用是除去
溶液的主要作用是除去 气体中温有的HCl
气体中温有的HClD.在试管B中发生反应的离子方程式为:

(3)硅酸钠溶液是一种粘稠的液体,这与硅酸根离子的长键结构有关:
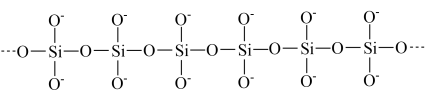
 俯视为
俯视为 简化为
简化为 连成长链
连成长链
 溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有
溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有 个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有
个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有
您最近一年使用:0次
名校
解题方法
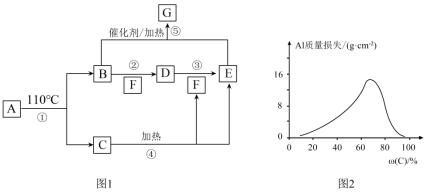
5 . A~G的转化关系如图1所示(部分产物略去),其中E为红棕色气体,G为单质。常温下,将Al片浸在不同质量分数的C溶液中,经过相同时间的腐蚀后,Al片的质量损失情况如图2所示。
(1)写出下列物质的化学式:A___________ 、E___________ 。
(2)反应④、⑤的化学方程式:④___________ 、⑤___________ 。
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为___________ 。
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是___________ mL。
(1)写出下列物质的化学式:A
(2)反应④、⑤的化学方程式:④
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
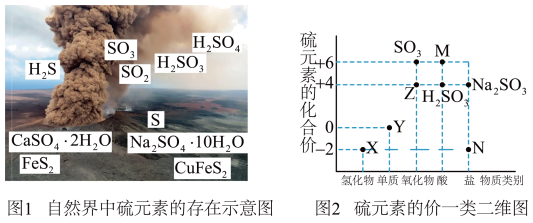
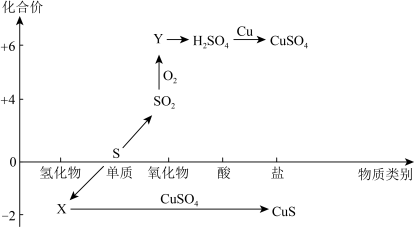
Ⅰ.自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:______________ 。
(2)X与Z反应中氧化剂与还原剂的物质的量之比为___________ 。
(3)Na2SO3溶液易被氧化成Na2SO4,检验Na2SO3溶液是否变质的试剂为_____________ 。
(4)铜和M的浓溶液反应生成Z的化学方程式为________________ 。
Ⅱ.氮氧化物(NOx)是大气污染物之一,处理NOx对于环境保护具有重要的意义。
在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。______________ 。
(6)在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,则该反应的化学方程式__________________ 。
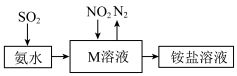
(7)工业生产中利用氨水吸收少量SO2和NO2,原理如图所示。NO2被吸收过程的离子方程式是_________________ 。
Ⅰ.自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:
(2)X与Z反应中氧化剂与还原剂的物质的量之比为
(3)Na2SO3溶液易被氧化成Na2SO4,检验Na2SO3溶液是否变质的试剂为
(4)铜和M的浓溶液反应生成Z的化学方程式为
Ⅱ.氮氧化物(NOx)是大气污染物之一,处理NOx对于环境保护具有重要的意义。
在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
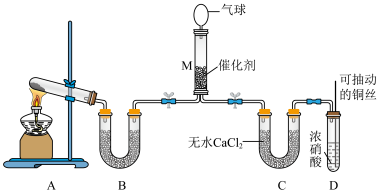
(6)在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,则该反应的化学方程式
(7)工业生产中利用氨水吸收少量SO2和NO2,原理如图所示。NO2被吸收过程的离子方程式是
您最近一年使用:0次
名校
解题方法
7 . 硫及其化合物的“价-类”二维图如下图所示,回答下列问题:___________ ,Y的化学式是___________ 。
(2)检验 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入___________ ,无明显现象,再加入___________ 溶液,若产生白色沉淀,则溶液中含有 。
。
(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。
①请用“双线桥”法标明该反应电子转移的方向和数目___________ 。
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为___________ L。
(2)检验
 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入 。
。(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓)
 CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。①请用“双线桥”法标明该反应电子转移的方向和数目
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为
您最近一年使用:0次
名校
解题方法
8 . 如图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。
已知:A为气体,A~F都含有相同的元素。
(1)写出物质F的化学式:_________________ 。
(2)D易溶于水。常温常压下(Vm=24.5L·mol-1),将体积为VmL的试管充满D后倒扣在水中。
①最终试管中所得E的物质的量浓度为(不考虑E的扩散)_________________ mol/L(保留两位小数) 。
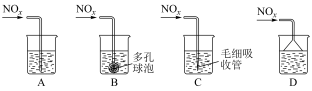
②若C、D按物质的量之比1:1被Na2CO3溶液吸收,只生成一种盐,则该反应的离子方程式是_____________________ 。为提高吸收速率与效率,最好选用_________________ 装置(填序号)。________ 。
已知:A为气体,A~F都含有相同的元素。

(1)写出物质F的化学式:
(2)D易溶于水。常温常压下(Vm=24.5L·mol-1),将体积为VmL的试管充满D后倒扣在水中。
①最终试管中所得E的物质的量浓度为(不考虑E的扩散)
②若C、D按物质的量之比1:1被Na2CO3溶液吸收,只生成一种盐,则该反应的离子方程式是
您最近一年使用:0次
名校
解题方法
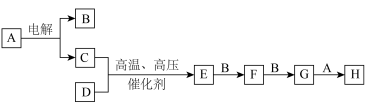
9 . 某些无机物的转化关系(部分反应物和生成物未列出)如图。已知化合物A为常见液体,气体E能使湿润的红色石蕊试纸变蓝。_____________ (填标号)。
a. b.
b.
(2)B、D在常温下难以发生反应,其主要原因为____________ 。
(3) 对人类的意义为
对人类的意义为_________________ (任写一点即可)。
(4)少量的E与氯气反应有白雾出现,写出该反应的化学方程式:______________ ;试推测过量的E与氯气反应的现象:_____________ 。
(5)用 溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:
溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:_________________ ,该反应中氧化产物与还原产物的物质的量之比为______________ 。
(6)常温常压下(气体摩尔体积为 ),将
),将 盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为
盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为______________  ,试管中所得溶液的物质的量浓度为
,试管中所得溶液的物质的量浓度为_____________  (用含
(用含 的代数式表示,假设溶质不向试管外扩散)。
的代数式表示,假设溶质不向试管外扩散)。
a.
 b.
b.
(2)B、D在常温下难以发生反应,其主要原因为
(3)
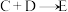 对人类的意义为
对人类的意义为(4)少量的E与氯气反应有白雾出现,写出该反应的化学方程式:
(5)用
 溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:
溶液可吸收F与G的混合气体,反应产物为水和一种钠盐,写出该反应的离子方程式:(6)常温常压下(气体摩尔体积为
 ),将
),将 盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为
盛满B、G混合气体(体积比为1:1)的试管倒立于水槽中,反应完全后,试管中剩余气体的体积为 ,试管中所得溶液的物质的量浓度为
,试管中所得溶液的物质的量浓度为 (用含
(用含 的代数式表示,假设溶质不向试管外扩散)。
的代数式表示,假设溶质不向试管外扩散)。
您最近一年使用:0次
2024-05-03更新
|
56次组卷
|
3卷引用:吉林省白山市抚松县第一中学2023-2024学年高一下学期4月月考化学试题
解题方法
10 . 非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
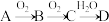
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___________ ,检验D的稀溶液中主要阴离子的试剂是___________ 。
②在工业生产中,B气体的大量排放被雨水吸收后会形成___________ 而污染环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为___________ 、___________ 。
②写出 转化的化学方程式
转化的化学方程式___________ 。
③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式___________ ,该反应中D体现的性质有___________ 。
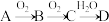
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是
②在工业生产中,B气体的大量排放被雨水吸收后会形成
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为
②写出
 转化的化学方程式
转化的化学方程式③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
您最近一年使用:0次




