解题方法
1 . 硫代硫酸钠 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。
(1)实验室可通过向含 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。

①写出制备 的化学方程式:
的化学方程式:________________ 。
②“一系列操作”包括________ 、________ 、过滤、洗涤、干燥。(填操作名称)
(2)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:_______ 。
(3)临床上, 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: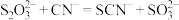 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为________________ 。
(4)工业上,测定 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。
相关反应: ;
;
 。
。
①该样品中 的质量分数为
的质量分数为________ (假设杂质不参与反应)。
②如果稀硫酸过多,测得结果会________ (填“偏高”、“偏低”或“无影响”)。
 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。(1)实验室可通过向含
 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。
①写出制备
 的化学方程式:
的化学方程式:②“一系列操作”包括
(2)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:(3)临床上,
 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: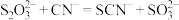 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为(4)工业上,测定
 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。相关反应:
 ;
; 。
。①该样品中
 的质量分数为
的质量分数为②如果稀硫酸过多,测得结果会
您最近半年使用:0次
名校
解题方法
2 . 人工固氮合成氨,并通过氨氧化法制取硝酸的流程如图所示。
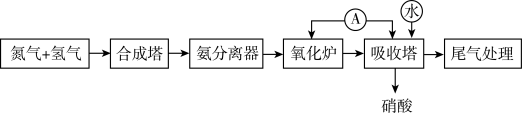
(1)“合成塔”内发生的化学反应中作氧化剂的是_______ (填化学式),金属镁在该氧化剂中燃烧的化学方程式为_______ ,其产物遇水生成的有刺激性气味气体的电子式为_______ ;“氧化炉”中氨气发生反应的化学方程式为_______ 。
(2)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是_______ 。
(3)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理NO2为例,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)取3.2 g铜与30 mL8 mol/L硝酸充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+,则生成的NO2的物质的量为_______ (用含a的代数式表示,下同)mol,NO的物质的量为_______ mol。

(1)“合成塔”内发生的化学反应中作氧化剂的是
(2)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是
(3)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理NO2为例,该反应中氧化剂与还原剂的物质的量之比为
(4)取3.2 g铜与30 mL8 mol/L硝酸充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含有a mol H+,则生成的NO2的物质的量为
您最近半年使用:0次
2022-05-02更新
|
592次组卷
|
3卷引用:云南省名校联盟2021-2022学年高一下学期期中考试化学试题
名校
解题方法
3 . (1)32g铜投入一定浓度的硝酸溶液中,铜完全溶解,共收集到NO和NO2的混合气体8.96 L气体(标准状况)。
①计算产生NO的体积(标准状况)___________ L;
②将盛有此混合气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为___________ L。
(2)向100 mL 0.8 mol·L-1硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出标准状况下的气体224 mL,且测得溶液中铁只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1 mol·L-1的NaOH溶液___________ mL。
①计算产生NO的体积(标准状况)
②将盛有此混合气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为
(2)向100 mL 0.8 mol·L-1硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出标准状况下的气体224 mL,且测得溶液中铁只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1 mol·L-1的NaOH溶液
您最近半年使用:0次
2021-04-07更新
|
503次组卷
|
2卷引用:吉林省白城市第一中学2020-2021学年高一下学期3月阶段性考试化学试题
解题方法
4 . 氮及氮的化合物有着重要的用途。
(1)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径_________________ (用化学方程式表示)。
(2)选择性催化还原技术(SCR)可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学 方程式:___________________ 。
(3)利用ClO2氧化氮氧化物反应过程如下:NO NO2
NO2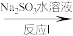 N2。反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,请写出反应Ⅱ转化关系的
N2。反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,请写出反应Ⅱ转化关系的离子 方程式___________________________ 。
(4)加入过量次氯酸钠可使废水中 完全转化为N2,而本身被还原为NaCl。
完全转化为N2,而本身被还原为NaCl。
①写出次氯酸的电子式__________________________________ 。
②上述反应中氧化剂和还原剂的物质的量之比为____________ ;若处理废水产生了0.448 L N2(标准状况),则至少需消耗浓度为2 mol·L-1的次氯酸钠的体积为______________ mL。
(5)“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是( )
A.风力发电,让能源更清洁 B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康 D.环保涂料,让环境更宜居
(1)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径
(2)选择性催化还原技术(SCR)可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的
(3)利用ClO2氧化氮氧化物反应过程如下:NO
 NO2
NO2 N2。反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,请写出反应Ⅱ转化关系的
N2。反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,请写出反应Ⅱ转化关系的(4)加入过量次氯酸钠可使废水中
 完全转化为N2,而本身被还原为NaCl。
完全转化为N2,而本身被还原为NaCl。①写出次氯酸的电子式
②上述反应中氧化剂和还原剂的物质的量之比为
(5)“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是
A.风力发电,让能源更清洁 B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康 D.环保涂料,让环境更宜居
您最近半年使用:0次
5 . 已知某种治疗胃病药品的主要成份是铝碳酸镁: ,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应.某研究性学习小组设计了如下实验探究铝碳酸镁片的组成.
,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应.某研究性学习小组设计了如下实验探究铝碳酸镁片的组成.
查阅资料:① 不溶于水,不与
不溶于水,不与 溶液反应②
溶液反应② 不溶于水,能与
不溶于水,能与 溶液反应生成可溶性的
溶液反应生成可溶性的 ,
, .取
.取 该药片,加入
该药片,加入 的稀硫酸,充分反应后滤去不溶物,得到含有
的稀硫酸,充分反应后滤去不溶物,得到含有 和
和 等溶质的滤液,向滤液中逐渐加入足量的稀
等溶质的滤液,向滤液中逐渐加入足量的稀 溶液,产生沉淀的质量与加入的溶液中
溶液,产生沉淀的质量与加入的溶液中 的质量的关系下图所示.
的质量的关系下图所示.
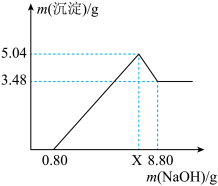
(1)图中当加入溶液中 的质量为
的质量为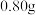 时仍没有沉淀,此阶段发生的化学方程式是
时仍没有沉淀,此阶段发生的化学方程式是_____ ,发生的反应是______ 反应(填基本反应类型).
(2)当加入溶液中 的质量到x时,生成的沉淀中
的质量到x时,生成的沉淀中 的质量是
的质量是_____ g.
(3)试确定铝碳酸镁的化学式中
____ (填最简整数比).
 ,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应.某研究性学习小组设计了如下实验探究铝碳酸镁片的组成.
,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应.某研究性学习小组设计了如下实验探究铝碳酸镁片的组成.查阅资料:①
 不溶于水,不与
不溶于水,不与 溶液反应②
溶液反应② 不溶于水,能与
不溶于水,能与 溶液反应生成可溶性的
溶液反应生成可溶性的 ,
, .取
.取 该药片,加入
该药片,加入 的稀硫酸,充分反应后滤去不溶物,得到含有
的稀硫酸,充分反应后滤去不溶物,得到含有 和
和 等溶质的滤液,向滤液中逐渐加入足量的稀
等溶质的滤液,向滤液中逐渐加入足量的稀 溶液,产生沉淀的质量与加入的溶液中
溶液,产生沉淀的质量与加入的溶液中 的质量的关系下图所示.
的质量的关系下图所示.
(1)图中当加入溶液中
 的质量为
的质量为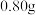 时仍没有沉淀,此阶段发生的化学方程式是
时仍没有沉淀,此阶段发生的化学方程式是(2)当加入溶液中
 的质量到x时,生成的沉淀中
的质量到x时,生成的沉淀中 的质量是
的质量是(3)试确定铝碳酸镁的化学式中

您最近半年使用:0次
2020-11-17更新
|
231次组卷
|
2卷引用:上海市部分重点高中2020-2021学年高一上学期10月阶段性测试化学试题
名校
解题方法
6 . “84 消毒液”是一种常用含氯消毒用品,可通过氯气与氢氧化钠反应制取,生成.物中有氯化钠、次氯酸钠(NaClO)和水,其中有效成分是次氯酸钠。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)写出制取“84”消毒液的化学方程式______________________ 。
(2)“84消毒液”中的有效氯来自次氯酸钠,次氯酸钠中氯元素的质量分数为______ % (计算结果精确到0.1%)
(3)现需要5 L有效氯浓度为500 mg/L 的稀溶液,选用有效氯浓度为50000 mg/L的某品牌“84消毒液”进行配制,需加水_______ 升 (忽略混合前后溶液体积的变化)。
(4)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应:NaClO+2HCl=X+Cl2↑+H2O,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
①X为_____ (填化学式)。
②通过计算分析,在10 m3密闭空间里,若将1.49 g 次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?____ (要求写出计算过程)。
(1)写出制取“84”消毒液的化学方程式
(2)“84消毒液”中的有效氯来自次氯酸钠,次氯酸钠中氯元素的质量分数为
(3)现需要5 L有效氯浓度为500 mg/L 的稀溶液,选用有效氯浓度为50000 mg/L的某品牌“84消毒液”进行配制,需加水
(4)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应:NaClO+2HCl=X+Cl2↑+H2O,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m3) | 对人体的影响 |
| 3000 | 可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120~170 | 极为危险,会引起急性肺水肿及肺炎 |
| 40~60 | 在1小时内便可致人严重中毒 |
①X为
②通过计算分析,在10 m3密闭空间里,若将1.49 g 次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?
您最近半年使用:0次
名校
7 . 取等物质的量浓度的NaOH溶液两份A和B,每份100 mL。向其中各通入一定量的CO2,然后各取溶液10 mL,分别向稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸。标准状况下,产生CO2气体体积与所加盐酸体积之间的关系如图所示。回答下列问题:
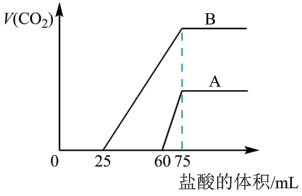
(1)曲线A表明原溶液中通入CO2后,所得溶液中的溶质为________ (写化学式),其物质的量之比为________ 。
(2)B曲线当耗盐酸0<V(HCl)<25 mL时发生的离子反应为:_______ 。加盐酸后,产生CO2体积的最大值为_______ mL(不考虑CO2的溶解)。写出向该NaOH溶液中通入CO2得到B溶液的离子反应方程式__________ 。
(3)通过计算求出原NaOH溶液的物质的量浓度_______ 。

(1)曲线A表明原溶液中通入CO2后,所得溶液中的溶质为
(2)B曲线当耗盐酸0<V(HCl)<25 mL时发生的离子反应为:
(3)通过计算求出原NaOH溶液的物质的量浓度
您最近半年使用:0次
2020-10-19更新
|
579次组卷
|
2卷引用:辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题
名校
解题方法
8 . 工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:4NH3+5O2 4NO+6H2O --① 4NO+3O2+2H2O→4HNO3---②
4NO+6H2O --① 4NO+3O2+2H2O→4HNO3---②
(1)如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是_____ (保留2位小数,下同。)
(2)现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31 g/cm3的硝酸,该硝酸的物质的量浓度是__________ mol/L。( 假设生产过程中反应物和生成物均无损耗)。
(3)把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到0.30 mol NO2和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量______ 。(写出计算过程)
(4)硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1 m3硝酸工业的尾气中含3160 mg NOx,其中n(NO) :n(NO2)=9:1。
①如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升? (富氧空气中O2的体积分数为0.25) (写出计算过程)___ 。
②如果用氨催化还原法,即用氨作还原剂,将NO、NO2 转化为氮气直接排入空气中,需要氨气的质量为多少克? (写出计算过程)_______ 。
 4NO+6H2O --① 4NO+3O2+2H2O→4HNO3---②
4NO+6H2O --① 4NO+3O2+2H2O→4HNO3---②(1)如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是
(2)现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31 g/cm3的硝酸,该硝酸的物质的量浓度是
(3)把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到0.30 mol NO2和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量
(4)硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1 m3硝酸工业的尾气中含3160 mg NOx,其中n(NO) :n(NO2)=9:1。
①如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升? (富氧空气中O2的体积分数为0.25) (写出计算过程)
②如果用氨催化还原法,即用氨作还原剂,将NO、NO2 转化为氮气直接排入空气中,需要氨气的质量为多少克? (写出计算过程)
您最近半年使用:0次
解题方法
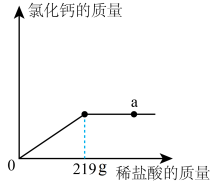
9 . 实验室模拟高温煅烧石灰石的方法制取二氧化碳,取35 g石灰石样品(假设杂质受热不分解,且不与酸反应),煅烧一段时间恢复到室温,测得生成11 g二氧化碳。向剩余固体中逐滴加入某盐酸至不再反应为止,又生成2.2 g二氧化碳,加入盐酸的质量与生成的氯化钙质量关系如图:
(1)石灰石样品的质量分数是_______ (结果保留一位小数,下同);
(2)a点溶液的pH_____ 7(填“<”“>”或“=”);
(3)求所加盐酸的溶质质量分数_____ (写出计算过程)。
(1)石灰石样品的质量分数是
(2)a点溶液的pH
(3)求所加盐酸的溶质质量分数

您最近半年使用:0次
2020-08-06更新
|
38次组卷
|
2卷引用:开学考试化学试卷04——2020年秋季高一新生入学分班考试化学试卷(全国通用)
19-20高二·浙江·阶段练习
解题方法
10 . 硫化钠由无水硫酸钠与炭粉在高温下反应制得的,反应的化学方程式为:
①Na2SO4+4C═Na2S+4CO↑;②Na2SO4+4CO═Na2S+4CO2↑.
(1)要制取Na2S 15.6g,需原料芒硝(Na2SO4•10H2O)__ g.
(2)已知在标准状况下,28gCO和44gCO2的体积相等都为22.4L.若在反应过程中,产生CO和CO2的混合气体在标准状况下的体积为44.8L,生成Na2S的质量为m,请通过计算确定m的取值范围__ .
①Na2SO4+4C═Na2S+4CO↑;②Na2SO4+4CO═Na2S+4CO2↑.
(1)要制取Na2S 15.6g,需原料芒硝(Na2SO4•10H2O)
(2)已知在标准状况下,28gCO和44gCO2的体积相等都为22.4L.若在反应过程中,产生CO和CO2的混合气体在标准状况下的体积为44.8L,生成Na2S的质量为m,请通过计算确定m的取值范围
您最近半年使用:0次



