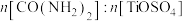名校
1 . 某兴趣小组设计用铜粉将NO还原为N2。
②NaOH溶液能吸收NO2,不能吸收NO。
(1)装置F的名称为___________ ,装置的连接顺序为a→___________ (装置只用一次)。
(2)装置C中发生反应的离子方程式为___________ 。
(3)装置D的作用为___________ 。
(4)E装置中可观察到的现象为___________ 。
(5)反应一段时间后拆下E装置,连接为如下图装置,一段时间后,无水硫酸铜变蓝色,生成无污染气体,写出通入氨气后E装置中发生反应的化学方程式:___________ 。


②NaOH溶液能吸收NO2,不能吸收NO。
(1)装置F的名称为
(2)装置C中发生反应的离子方程式为
(3)装置D的作用为
(4)E装置中可观察到的现象为
(5)反应一段时间后拆下E装置,连接为如下图装置,一段时间后,无水硫酸铜变蓝色,生成无污染气体,写出通入氨气后E装置中发生反应的化学方程式:

您最近一年使用:0次
2024-01-29更新
|
201次组卷
|
2卷引用:山东省青岛第五十八中学2023-2024学年高一上学期1月月考化学试题
名校
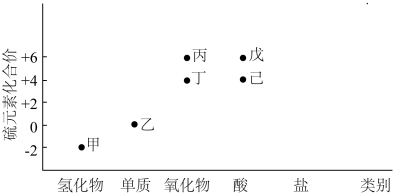
2 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度,下图是硫及其部分化合物的“价类二维图”。

回答下列问题:
(1)图中七种物质中,属于非电解质的是___________ (填化学式)。
(2)将 气体通入
气体通入 的水溶液变浑浊,该反应中氧化产物和还原产物的质量比
的水溶液变浑浊,该反应中氧化产物和还原产物的质量比___________ 。
(3)从氧化还原的角度分析,欲制备硫代硫酸钠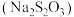 ,下列方案合理的是
,下列方案合理的是_______ (填编号)
a.S和 b.
b. 和浓
和浓 c.
c. 和
和 d.
d. 和
和
(4)某小组同学设计实验实现几种价态硫元素的转化。
可选用的实验药品如下:① 溶液;②浓硫酸;③
溶液;②浓硫酸;③ 溶液;④稀硫酸;⑤酸性
溶液;④稀硫酸;⑤酸性 溶液;⑥品红溶液;⑦铜片。
溶液;⑥品红溶液;⑦铜片。
a.实验i选择的试剂是___________ (填序号),证明实现转化的现象是___________ 。
b.实验ii实现了 价和
价和 价S向0价S的转化,每生成
价S向0价S的转化,每生成 硫单质,转移的电子数目为
硫单质,转移的电子数目为_________ 。
c.实验iii中发生反应的化学方程式是___________ 。

回答下列问题:
(1)图中七种物质中,属于非电解质的是
(2)将
 气体通入
气体通入 的水溶液变浑浊,该反应中氧化产物和还原产物的质量比
的水溶液变浑浊,该反应中氧化产物和还原产物的质量比(3)从氧化还原的角度分析,欲制备硫代硫酸钠
 ,下列方案合理的是
,下列方案合理的是a.S和
 b.
b. 和浓
和浓 c.
c. 和
和 d.
d. 和
和
(4)某小组同学设计实验实现几种价态硫元素的转化。
可选用的实验药品如下:①
 溶液;②浓硫酸;③
溶液;②浓硫酸;③ 溶液;④稀硫酸;⑤酸性
溶液;④稀硫酸;⑤酸性 溶液;⑥品红溶液;⑦铜片。
溶液;⑥品红溶液;⑦铜片。| 实验序号 | 预期转化 | 选择试剂 | 证明实现转化的现象 |
| i |  | ||
| ii | ①、③、④ | 淡黄色沉淀 | |
| iii |  | ②、⑦、⑥ |
b.实验ii实现了
 价和
价和 价S向0价S的转化,每生成
价S向0价S的转化,每生成 硫单质,转移的电子数目为
硫单质,转移的电子数目为c.实验iii中发生反应的化学方程式是
您最近一年使用:0次
名校
3 . 硫是价态多变的非金属元素,其中含有+3、+4价硫的化合物具有较强还原性。
Ⅰ.连二亚硫酸钠(Na2S2O4)。广泛应用于造纸等行业。利用NaBH4(H为-1价)溶液和Zn还原含硫物质均可制得Na2S2O4.实验室利用NaBH4碱性溶液制取Na2S2O4,实验装置如下图所示。
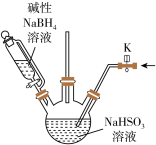
(1)实验前需打开K通入一段时间氮气,其目的是______ 。
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2.制备Na2S2O4的化学方程式为______ 。
Ⅱ.SO2、Na2SO3、Na2S2O5(焦亚硫酸钠)中都含有+4价的S。
(3)工业上常用SO2还原法制备粗碲:一定条件下,将SO2通入TeOSO4溶液中,反应一段时间后过滤、洗涤得到粗Te.反应中n(SO2):n(TeOSO4)=______ 。
(4)Na2SO3是实验室常用试剂。
①实验室用Na2SO3固体与浓硫酸制备SO2,该反应的化学方程式为______ 。
②在溴水中加入Na2SO3溶液反应的离子方程式为______ 。
(5)焦亚硫酸钠(Na2S2O5)空气法处理含氰废水的部分机理如下,其中[O]代表活性氧原子,具有强氧化性,发生如下反应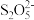 +H2O=2
+H2O=2 +2H+、
+2H+、 +O2=
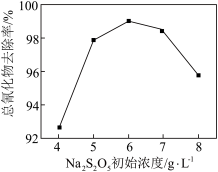
+O2= +[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g/L时,总氰化物去除率下降的原因可能是
+[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g/L时,总氰化物去除率下降的原因可能是______ 。
Ⅰ.连二亚硫酸钠(Na2S2O4)。广泛应用于造纸等行业。利用NaBH4(H为-1价)溶液和Zn还原含硫物质均可制得Na2S2O4.实验室利用NaBH4碱性溶液制取Na2S2O4,实验装置如下图所示。

(1)实验前需打开K通入一段时间氮气,其目的是
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2.制备Na2S2O4的化学方程式为
Ⅱ.SO2、Na2SO3、Na2S2O5(焦亚硫酸钠)中都含有+4价的S。
(3)工业上常用SO2还原法制备粗碲:一定条件下,将SO2通入TeOSO4溶液中,反应一段时间后过滤、洗涤得到粗Te.反应中n(SO2):n(TeOSO4)=
(4)Na2SO3是实验室常用试剂。
①实验室用Na2SO3固体与浓硫酸制备SO2,该反应的化学方程式为
②在溴水中加入Na2SO3溶液反应的离子方程式为
(5)焦亚硫酸钠(Na2S2O5)空气法处理含氰废水的部分机理如下,其中[O]代表活性氧原子,具有强氧化性,发生如下反应
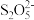 +H2O=2
+H2O=2 +2H+、
+2H+、 +O2=
+O2= +[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g/L时,总氰化物去除率下降的原因可能是
+[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g/L时,总氰化物去除率下降的原因可能是
您最近一年使用:0次
4 . 甲、乙、丙、丁四种物质存在如下转化关系:甲 丙
丙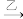 丁。
丁。
(1)若甲、乙均为空气的主要成分,甲所含元素的简单阴离子的结构示意图为___________ 。
(2)若乙是生活中常见的金属单质,丙→丁的离子方程式为___________ 。
(3)若丙既能与强酸又能与强碱反应,则丙的化学式为___________ (任写1种)。
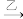 丙
丙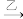 丁。
丁。(1)若甲、乙均为空气的主要成分,甲所含元素的简单阴离子的结构示意图为
(2)若乙是生活中常见的金属单质,丙→丁的离子方程式为
(3)若丙既能与强酸又能与强碱反应,则丙的化学式为
您最近一年使用:0次
5 . 高中化学课本必修一中出现的部分物质间的转化关系如图所示(部分物质已省略。已知A→B是实验室制取氯气的主要方法之一,H的焰色试验呈黄色,气体为密度最小的气体H2),请完成下列填空。___________ 。
(2)若K中含有F的杂质,应加入___________ (填化学式)除杂。
(3)I转化为J的化学方程式为___________ 。
(4)K的饱和溶液滴入沸水中,可得到胶体L。胶体L中加入足量稀硫酸的实验现象为___________ 。
(5)将B通入G溶液中可得到一种漂白液,能杀菌、消毒,该漂白液的有效成分是___________ (填化学式)。
(6)ClO2为公认的高效安全灭菌消毒剂之一,常温下亚氯酸钠(NaClO2)溶液与B反应可得到ClO2和NaCl,该反应中的离子方程式为___________ 。
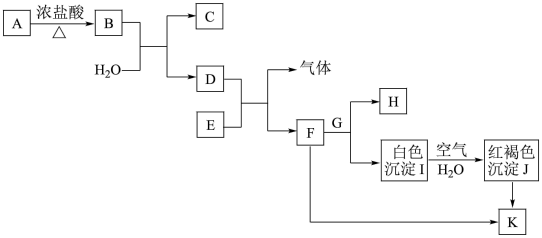
(2)若K中含有F的杂质,应加入
(3)I转化为J的化学方程式为
(4)K的饱和溶液滴入沸水中,可得到胶体L。胶体L中加入足量稀硫酸的实验现象为
(5)将B通入G溶液中可得到一种漂白液,能杀菌、消毒,该漂白液的有效成分是
(6)ClO2为公认的高效安全灭菌消毒剂之一,常温下亚氯酸钠(NaClO2)溶液与B反应可得到ClO2和NaCl,该反应中的离子方程式为
您最近一年使用:0次
6 . 利用下图,可以从不同角度研究含硫物质的性质及其转化关系,图中物质甲~己中均含有硫元素.回答下列问题:
(1)写出甲的电子式:_______ ,该物质中的硫元素可表现出___________ (填“氧化性”或“还原性”);利用高温热分解甲可以获得乙,该方法的优点是______________ ,缺点是_____________ .
(2)黄铁矿(主要成分为 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是__________ (填“丙”或“丁”),该物质与水化合生成___________ (填化学名称).
(3)① 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为_______________________________ .
②同位素示踪实验可证实 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为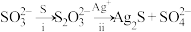 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为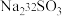 和
和 ,过程ii含硫产物是
,过程ii含硫产物是_____________ (标记出同位素原子).

(1)写出甲的电子式:
(2)黄铁矿(主要成分为
 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是(3)①
 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为②同位素示踪实验可证实
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为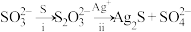 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为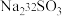 和
和 ,过程ii含硫产物是
,过程ii含硫产物是
您最近一年使用:0次
解题方法
7 . 纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛(TiOSO4)为原料制备纳米二氯化钛的工艺流程图:

已知:铵盐受热易分解。回答下列问题:
(1)反应1中发生两个反应,其一是尿素[ ]与
]与 反应生成
反应生成 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为__________ 。
(2)判断 沉淀是否洗净的实验操作和现象是
沉淀是否洗净的实验操作和现象是__________ 。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过(填基本操作)__________ 、__________ 、过滤洗涤、干燥即可回收__________ (填化学式)。
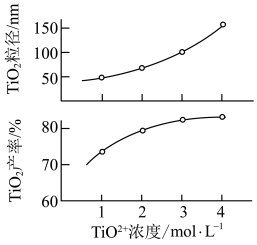
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米 产率的影响,设计如下实验。
产率的影响,设计如下实验。
ⅰ.实验③中反应物物质的量配比为__________ 。
ⅱ.反应Ⅰ中 浓度对
浓度对 的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的
的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的 浓度为
浓度为__________ 。

已知:铵盐受热易分解。回答下列问题:
(1)反应1中发生两个反应,其一是尿素[
 ]与
]与 反应生成
反应生成 和
和 ,则该反应的化学方程式为
,则该反应的化学方程式为(2)判断
 沉淀是否洗净的实验操作和现象是
沉淀是否洗净的实验操作和现象是(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过(填基本操作)
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米
 产率的影响,设计如下实验。
产率的影响,设计如下实验。实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2∶1 |
② | 90 | 2 | 3∶1 |
③ | 90 | 1 | |
④ | 110 | 2 | 3∶1 |
ⅱ.反应Ⅰ中
 浓度对
浓度对 的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的
的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的 浓度为
浓度为
您最近一年使用:0次
8 . 现有 七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
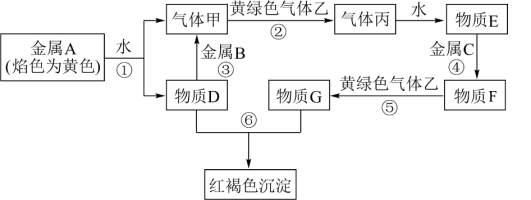
(1)写出下列物质的化学式:B___________ 、C___________ 。
(2)A物质在空气中燃烧的产物是___________ 色的粉末,该物质与 反应的方程式为
反应的方程式为___________ 。
(3)写出反应③的离子反应方程式:___________ 。
(4)在物质 中加入
中加入 溶液,现象为
溶液,现象为___________ ,发生反应的化学方程式为___________ 。
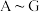 七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
七种物质,它们之间能发生如下反应(图中部分反应物、产物及反应条件未标出)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B
(2)A物质在空气中燃烧的产物是
 反应的方程式为
反应的方程式为(3)写出反应③的离子反应方程式:
(4)在物质
 中加入
中加入 溶液,现象为
溶液,现象为
您最近一年使用:0次
9 . 氯气、“84”消毒液、漂白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备“84”消毒液、漂白粉,并收集纯净干燥的氯气。回答下列问题:

(1)装置甲中发生反应的化学方程式为_______ ,盛装浓盐酸的仪器的名称为_______ 。
(2)装置丁用来收集纯净且干燥的氯气,进气口为_______ (填a或b);装置乙和丙盛装的试剂分别是_______ 。(填名称)
(3)将氯气通入装置己中制备“84”漂白液,则装置己中发生反应的离子方程式为:_______ ,有同学认为装置己还有一个作用,该作用为_______ ,发挥该作用_______ (填“能”或“不能”)用澄清石灰水代替。
(4)装置戊中盛装石灰乳用来制备漂白粉,则
①装置戊中发生反应的化学方程式为:_______ 。
②装置戊中采用冰水浴的原因是_______ 。
③漂白粉长时间暴露在空气中容易发生变质的原因为_______ (结合化学方程式说明)。

(1)装置甲中发生反应的化学方程式为
(2)装置丁用来收集纯净且干燥的氯气,进气口为
(3)将氯气通入装置己中制备“84”漂白液,则装置己中发生反应的离子方程式为:
(4)装置戊中盛装石灰乳用来制备漂白粉,则
①装置戊中发生反应的化学方程式为:
②装置戊中采用冰水浴的原因是
③漂白粉长时间暴露在空气中容易发生变质的原因为
您最近一年使用:0次
解题方法
10 . 84消毒液是一种常见的含氯消海剂。如图为某品牌84消毒液的说明书中的部分内容。
(1)常温将氯气通入氢氧化钠溶液可制得84消毒液的主要成分,写出相应离子方程式______________ 。
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
Ⅰ.向2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
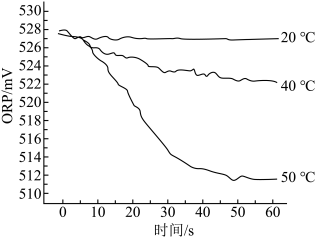
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______________________ 。
②实验Ⅲ不同温度时ORP值不同的原因可能是____________________ 。
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生O2的促进藻类快速生长。写出该反应的化学方程式_________________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生如下反应: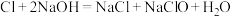 ;
;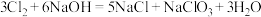 。经测定ClO-与
。经测定ClO-与 的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为___________ 。
| 产品特点: 本品是以次氯钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项: 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 |
(1)常温将氯气通入氢氧化钠溶液可制得84消毒液的主要成分,写出相应离子方程式
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
Ⅰ.向2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.向2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验Ⅲ不同温度时ORP值不同的原因可能是
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生O2的促进藻类快速生长。写出该反应的化学方程式
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生如下反应:
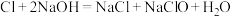 ;
;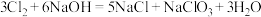 。经测定ClO-与
。经测定ClO-与 的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
的数目之比为1∶3,则氯气与氢氧化钠溶液反应时,被还原的氯元素和被氧化的氯元素的质量之比为
您最近一年使用:0次