名校
解题方法
1 . 亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
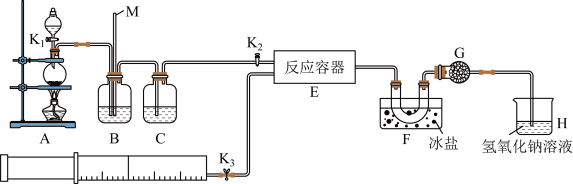
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___ 。
(2)装置B的作用是①__ ,②___ 。
(3)若用A装置制取NO气体,B中应该盛放__ 。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__ 。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__ 同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__ 。(仅提供的试剂:1mol•L-1HCl、1mol•L-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___ 做指示剂。
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__ 。

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式
(2)装置B的作用是①
(3)若用A装置制取NO气体,B中应该盛放
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20mol•L-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用
| 物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
| 颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
| Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为
您最近一年使用:0次
19-20高三·江西南昌·阶段练习
解题方法
2 . 三氯化硼的熔点-107.3℃,沸点为12.5℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为:B2O3+3C+3Cl2 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
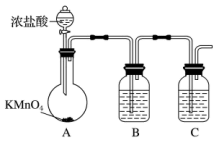
①装置B的作用是___________ ,装置C中盛放的试剂是___________ 。
②装宜A中发生反应的离子方程式为_______________ 。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
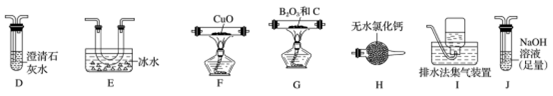
①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。____________
②能证明反应中有CO生成的现象是_____________ 。
③开始反应时,先后(选填下列序号)______________ 。
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式_____________ 。
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象____________ 。
 2BCl3+3CO。
2BCl3+3CO。(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B的作用是
②装宜A中发生反应的离子方程式为
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。

①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。
②能证明反应中有CO生成的现象是
③开始反应时,先后(选填下列序号)
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象
您最近一年使用:0次
3 . 铝氢化钠(NaAlH4)是有机合成中的一种重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝氢化钠的一种工艺流程如图:
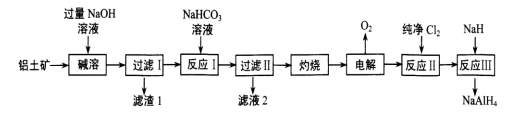
下列说法中错误的是

下列说法中错误的是
| A.为了提高“碱溶”效率,在“碱溶”前对铝土矿进行粉碎 |
| B.“反应I”的部分化学原理与泡沫灭火器的原理相同 |
| C.“滤渣1”的主要成分为氧化铁 |
| D.“反应III”的化学方程式为4NaH+AlCl3=NaAlH4+3NaCl |
您最近一年使用:0次
2021-02-23更新
|
1732次组卷
|
11卷引用:江西省丰城市第九中学2021-2022学年高三复读班上学期10月月考化学试题
江西省丰城市第九中学2021-2022学年高三复读班上学期10月月考化学试题湖北省武汉市武昌区2021届高三1月质量检测化学试题(已下线)热点8 无机化工流程分析(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)河南省郑州市维纲中学2022届高三9月月考化学试题山西省太原师范学院附属中学2022-2023 学年高三上学期第一次月考化学试题山西省榆次第一中学校 2022-2023学年高三上学期10 月模拟考试化学试题安徽省六安第一中学2022-2023学年高三上学期第二次月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高三上学期10月月考化学试题内蒙古自治区呼和浩特市2022-2023学年高三上学期质量普查调研考试化学试题
4 . 亚硝酰氯(NOCl)常用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成亚硝酰氯。
已知:①NOCl是黄色气体,熔点:—64.5℃,沸点:—5.5℃;NOCl遇水易反应生成一种无氧酸和两种氮的常见氧化物;NOCl对眼睛、皮肤和黏膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。
②Ag2CrO4是砖红色沉淀。
实验1:制备原料气NO和Cl2
利用如图1所示装置制备纯净的NO和Cl2。
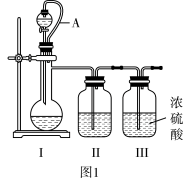
(1)制备纯净的Cl2,烧瓶中反应的化学方程式为___ 。
(2)制备纯净的NO,烧瓶中盛有Cu,装置Ⅱ中盛有___ (填试剂名称);导管A的作用是___ 。
实验2:制备NOCl。
利用实验1中制得的NO和Cl2制备NOCl,装置如图2所示。
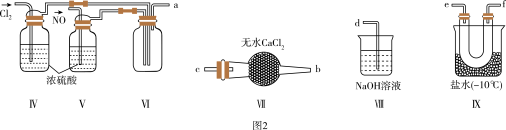
(3)仪器接口的连接顺序为a→___ (按气流从左到右顺序填写)。
(4)装置Ⅳ、Ⅴ除进一步干燥NO和Cl2外,另一作用是____ 。
(5)装置Ⅷ用于吸收尾气,NOCl发生反应的化学方程式为____ 。
实验3:测定NOCl的纯度
将所得亚硝酰氯(NOCl)产品13.5g溶于水,配成250ml该溶液,取出25.00ml该溶液,以K2CrO4溶液为指示剂,用1.0mol/LAgNO3标准溶液滴定至终点,再重复上述实验操作2次,测得三次实验消耗AgNO3标准溶液的平均体积为20.00ml。
(6)达到滴定终点的现象是____ 。
(7)产品中亚硝酰氯(NOCl)的质量分数为___ (保留两位小数)。
已知:①NOCl是黄色气体,熔点:—64.5℃,沸点:—5.5℃;NOCl遇水易反应生成一种无氧酸和两种氮的常见氧化物;NOCl对眼睛、皮肤和黏膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。
②Ag2CrO4是砖红色沉淀。
实验1:制备原料气NO和Cl2
利用如图1所示装置制备纯净的NO和Cl2。

(1)制备纯净的Cl2,烧瓶中反应的化学方程式为
(2)制备纯净的NO,烧瓶中盛有Cu,装置Ⅱ中盛有
实验2:制备NOCl。
利用实验1中制得的NO和Cl2制备NOCl,装置如图2所示。

(3)仪器接口的连接顺序为a→
(4)装置Ⅳ、Ⅴ除进一步干燥NO和Cl2外,另一作用是
(5)装置Ⅷ用于吸收尾气,NOCl发生反应的化学方程式为
实验3:测定NOCl的纯度
将所得亚硝酰氯(NOCl)产品13.5g溶于水,配成250ml该溶液,取出25.00ml该溶液,以K2CrO4溶液为指示剂,用1.0mol/LAgNO3标准溶液滴定至终点,再重复上述实验操作2次,测得三次实验消耗AgNO3标准溶液的平均体积为20.00ml。
(6)达到滴定终点的现象是
(7)产品中亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
2020-08-21更新
|
443次组卷
|
3卷引用:江西省红色七校(分宜中学、会昌中学、莲花中学、南城一中、任弼时中学、瑞金一中、遂川中学)2021届高三3月第二次联考理综化学试题
5 . “翠矾”(NiSO4·7H2O)在印染工业作媒染剂,生产酞菁艳蓝络合剂;氟镍化钾(K2NiF4)是结构化学研究的热点物质。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料合成“翠矾”和氟镍化钾的流程如下:
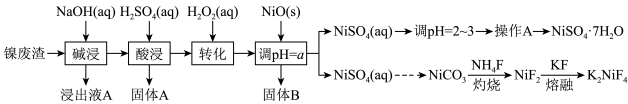
几种金属离子的氢氧化物沉淀pH如下:
请回答下列问题:
(1)翠矾、绿矾、明矾、蓝矾等“矾类”都含有______ 元素(填元素符号)。pH=a的范围为___________ 。
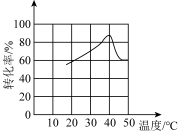
(2)“转化”过程中一定体积和浓度的双氧水,“转化率”与温度关系如图1所示。温度高于40℃,转化率急速降低的原因可能是______ 。空气可以替代双氧水,空气的作用是______ (用离子方程式表示)。
(3)NiSO4和NH4HCO3溶液生成NiCO3,其离子方程式为___________ 。
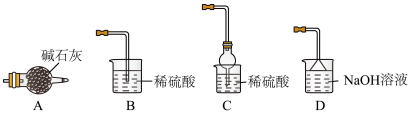
(4)灼烧NiCO3和NH4F以物质的量之比为1:1组成的混合物时,为避免污染环境,选择下列装置吸收尾气,最宜选择___________ 。(填选项)
(5)已知常温下,Ksp(NiCO3)=1.42×10-7。分离NiCO3时滤液中c(Ni2+)≤1.0×10-5 mol·L-1时,c(CO )≥
)≥___________ mol·L-1。
(6)准确称取ω g翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250 mL溶液,取20.00 mL所配溶液于锥形瓶,用c mol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02 mL、19.98 mL、19.50 mL,则翠矾的纯度为___________ %(只列计算式,不考虑杂质反应)。

几种金属离子的氢氧化物沉淀pH如下:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 5.2 |
Fe2+ | 7.6 | 9.7 |
Ni2+ | 7.1 | 9.2 |

请回答下列问题:
(1)翠矾、绿矾、明矾、蓝矾等“矾类”都含有
(2)“转化”过程中一定体积和浓度的双氧水,“转化率”与温度关系如图1所示。温度高于40℃,转化率急速降低的原因可能是
(3)NiSO4和NH4HCO3溶液生成NiCO3,其离子方程式为
(4)灼烧NiCO3和NH4F以物质的量之比为1:1组成的混合物时,为避免污染环境,选择下列装置吸收尾气,最宜选择

(5)已知常温下,Ksp(NiCO3)=1.42×10-7。分离NiCO3时滤液中c(Ni2+)≤1.0×10-5 mol·L-1时,c(CO
 )≥
)≥(6)准确称取ω g翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250 mL溶液,取20.00 mL所配溶液于锥形瓶,用c mol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02 mL、19.98 mL、19.50 mL,则翠矾的纯度为
您最近一年使用:0次



