解题方法
1 . 《环境科学》刊发了我国科研部门采用零价铁活化过二硫酸钠(Na2S2O8) 去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。下列叙述不正确的是
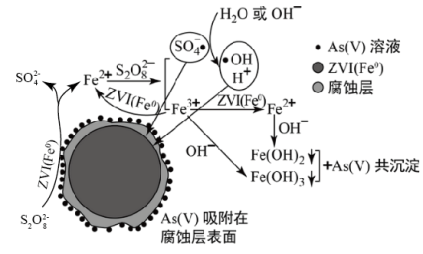

A.56gFe参加反应,消耗的S2O 大于1 mol 大于1 mol |
| B.过二硫酸钠(Na2S2O8) 中S的化合价为+6 |
| C.pH越大,越有利于去除废水中的正五价砷 |
D.碱性条件下,硫酸根自由基发生反应的方程式为:  +H2O= SO +H2O= SO + + +H+ +H+ |
您最近一年使用:0次
名校
解题方法
2 . 高纯度二氧化碳主要是用于电子工业、医药研究、检测仪器的校正气。某课外小组测定CO2相对分子质量的实验装置如下图所示,装置①中装有石灰石和稀盐酸,石灰石中往往含有S的化合物(如FeS)等杂质,下列说法正确的是( )
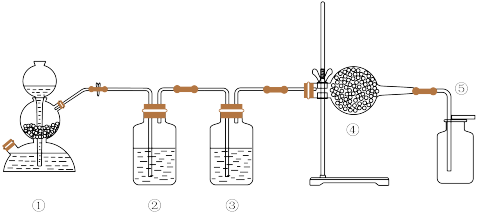

| A.装置③④中依次盛装饱和碳酸氢钠溶液、硅胶 |
| B.由于二氧化碳气体略重于空气,所以应把装置⑤中的导管口靠近瓶底 |
| C.过氧化钠固体与水反应制备氧气也可用装置① |
D.实验前后两次称量装置⑤的质量,分别为m1、m2,测得的集气瓶容积为V L,则二氧化碳的相对分子质量为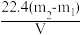 |
您最近一年使用:0次
名校
解题方法
3 . 已知:还原性 >I-,氧化性
>I-,氧化性 >I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
>I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是

 >I-,氧化性
>I-,氧化性 >I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
>I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
A.0~a间发生反应3 + + ===3 ===3 +I-+3H+ +I-+3H+ |
| B.a~b间共消耗NaHSO3的物质的量为1.2mol |
| C.b~c间发生的反应中I2既是氧化产物又是还原产物 |
| D.当溶液中I-与I2的物质的量之比为5∶2时,加入的KIO3为1.08mol |
您最近一年使用:0次
2020-08-24更新
|
83次组卷
|
2卷引用:湖南省衡阳市第一中学2021届高三上学期第一次月考化学试题
名校
4 . 氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。

(1)仪器d的名称___________
(2)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的结构式__________________ 。
(3)装置a中的溶液为_________ ;f装置的作用为__________________________________________ 。
(4)该实验的操作顺序应为_______________________________ (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式____________________________________________ 。

(1)仪器d的名称
(2)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的结构式
(3)装置a中的溶液为
(4)该实验的操作顺序应为
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式
您最近一年使用:0次
解题方法
5 . 硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。

请回答下列问题:
(1)下列物质中最适合的氧化剂B是____________________ ;
a.NaClO b.H2O2c.KMnO4d.K2Cr2O7
反应的离子方程式____________________ 。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液?并说明理由____________________ 。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH 的方法是
的方法是____________________ 。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为____________________ 。

请回答下列问题:
(1)下列物质中最适合的氧化剂B是
a.NaClO b.H2O2c.KMnO4d.K2Cr2O7
反应的离子方程式
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液?并说明理由
(3)检验硫酸铁铵中NH
 的方法是
的方法是(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为
您最近一年使用:0次
2016-12-09更新
|
279次组卷
|
3卷引用:2015届湖南省衡阳市八中高三上学期月考理综化学试卷
名校
6 . 由铝硅两种物质组成的试样11 g,均匀地分成等质量的两份,一份与足量的盐酸接触可产生气体a L,一份与足量的NaOH溶液接触产生同样的气体b L,则此试样中铝与硅的质量比为
| A.4a /3(b-a) | B.9a/7(b-a) | C.a/(b-a) | D.无法计算 |
您最近一年使用:0次
2016-12-09更新
|
161次组卷
|
3卷引用:湖南省衡阳市第八中学2017届高三上学期第四次月考化学(实验班)试题
名校
7 . 向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1∶6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2016-11-17更新
|
3612次组卷
|
21卷引用:2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷
2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷2016届辽宁省沈阳市第二中学高三10月月考化学试卷2017届辽宁省瓦房店市高级中学高三上10月月考化学试卷四川省眉山中学2018届高三10月月考理科综合化学试题甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题甘肃省天水市一中2018届高三上学期第三学段考试化学试题(已下线)《2018,我的高考我的教师君》-【临考技能篇】速解高考题——高考化学题型分类技巧指导(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密四川省广安市第二中学2019届高三上学期第一次月考化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)2019年1月16日 《每日一题》高考二轮复习-铁及其化合物辽宁省实验中学2022-2023学年高三上学期期中考试化学试题江西省宜春市丰城拖船中学2023-2024学年高三上学期11月期中化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题浙江省台州市书生中学2021-2022学年高一下学期阶段性测试(3月)化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期中考试化学试题湖南省邵东市第一中学2021-2022学年高一下学期第三次月考化学试题河南省周口市太康县第一高级中学2023-2024学年高一下学期4月第三次月考化学试题



