解题方法
1 . 某校化学兴趣小组为研究Cl2的性质并制备氯水,用如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
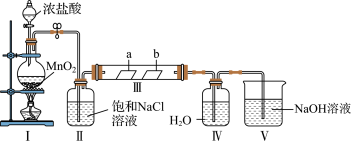
(1)加入药品前,检查I中气体发生装置气密性的操作是__ 。
(2)装置Ⅰ中发生反应的化学方程式为__ 。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在__ 和___ (填装置序号)之间添加洗气装置,该装置的作用是___ 。
(4)装置V中NaOH溶液的作用是__ ,相关反应的化学方程式为___ 。
(5)反应完毕,为探究装置Ⅳ中溶质的成分,需要的试剂主要有__ 。

(1)加入药品前,检查I中气体发生装置气密性的操作是
(2)装置Ⅰ中发生反应的化学方程式为
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在
(4)装置V中NaOH溶液的作用是
(5)反应完毕,为探究装置Ⅳ中溶质的成分,需要的试剂主要有
您最近一年使用:0次
2020-02-24更新
|
86次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州晴隆县第二中学2019-2020学年高一上学期期末考试化学试题
解题方法
2 . 某研究小组制备氯气并对产生氯气的条件进行探究。
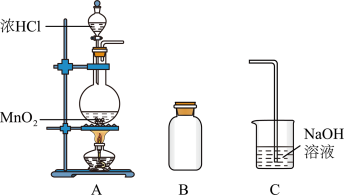
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________ 。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________ 。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________ 。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________ ;
将ⅰ、ⅱ作对比,得出的结论是___________________________________ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质可能是
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol L-1浓盐酸混合 L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ 中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol L-1稀盐酸混合物 L-1稀盐酸混合物 | 无明显现象 |
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是
将ⅰ、ⅱ作对比,得出的结论是
您最近一年使用:0次
2020-02-23更新
|
402次组卷
|
4卷引用:贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高一上学期期末考试化学试题
3 . 化学小组同学为研究氯气制备和氯水的成分及性质进行了如下实验。
【实验1】制备氯气。如图是实验室制取纯净、干燥氯气的装置图。
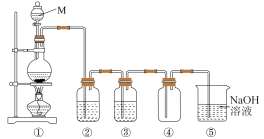
(1)M的名称是___________ ,①中反应的化学方程式是___________ 。
(2)③中存放的试剂是___________ 。(填“浓硫酸”或“饱和食盐水”)
(3)⑤中NaOH溶液的作用是___________ 。
【实验1】制备氯气。如图是实验室制取纯净、干燥氯气的装置图。

(1)M的名称是
(2)③中存放的试剂是
(3)⑤中NaOH溶液的作用是
您最近一年使用:0次
名校
4 . 二氧化氯(ClO2)是一种新型高效安全消毒剂,易溶于水,沸点为 ,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备
,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备 :向三颈烧瓶中加入
:向三颈烧瓶中加入 溶液、浓
溶液、浓 并通入空气,调节恒温器至
并通入空气,调节恒温器至 ,通过固体加料器缓慢匀速加入硫铁矿粉末。
,通过固体加料器缓慢匀速加入硫铁矿粉末。
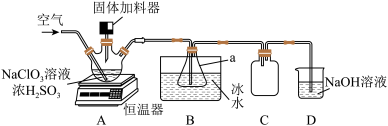
回答下列问题:
(1)仪器a的名称是_______ 。
(2)A装置中生成 的离子方程式为
的离子方程式为_______ ( 对应的产物为
对应的产物为 和
和 ),此离子反应中氧化产物与还原产物的物质的量之比为
),此离子反应中氧化产物与还原产物的物质的量之比为_______ 。
(3)装置C的作用是_______ 。
(4)装置D中 与NaOH溶液反应生成二种盐,其中一种为
与NaOH溶液反应生成二种盐,其中一种为 且二者物质的量之比为
且二者物质的量之比为 ,则另一种盐的化学式为
,则另一种盐的化学式为_______ 。
(5)一种主要成分为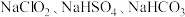 的“
的“ 泡腾片”,能快速溶于水,并产生大量气泡,得到含有
泡腾片”,能快速溶于水,并产生大量气泡,得到含有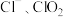 的溶液。上述过程中,每生成
的溶液。上述过程中,每生成 消耗
消耗 的物质的量为
的物质的量为_______ mol。
(6)工业上可用 与水中的
与水中的 在常温下反应,生成
在常温下反应,生成 和盐酸,以除去水中
和盐酸,以除去水中 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
 ,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备
,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备 :向三颈烧瓶中加入
:向三颈烧瓶中加入 溶液、浓
溶液、浓 并通入空气,调节恒温器至
并通入空气,调节恒温器至 ,通过固体加料器缓慢匀速加入硫铁矿粉末。
,通过固体加料器缓慢匀速加入硫铁矿粉末。
回答下列问题:
(1)仪器a的名称是
(2)A装置中生成
 的离子方程式为
的离子方程式为 对应的产物为
对应的产物为 和
和 ),此离子反应中氧化产物与还原产物的物质的量之比为
),此离子反应中氧化产物与还原产物的物质的量之比为(3)装置C的作用是
(4)装置D中
 与NaOH溶液反应生成二种盐,其中一种为
与NaOH溶液反应生成二种盐,其中一种为 且二者物质的量之比为
且二者物质的量之比为 ,则另一种盐的化学式为
,则另一种盐的化学式为(5)一种主要成分为
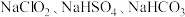 的“
的“ 泡腾片”,能快速溶于水,并产生大量气泡,得到含有
泡腾片”,能快速溶于水,并产生大量气泡,得到含有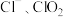 的溶液。上述过程中,每生成
的溶液。上述过程中,每生成 消耗
消耗 的物质的量为
的物质的量为(6)工业上可用
 与水中的
与水中的 在常温下反应,生成
在常温下反应,生成 和盐酸,以除去水中
和盐酸,以除去水中 。写出该反应的离子方程式:
。写出该反应的离子方程式:
您最近一年使用:0次
2022-10-08更新
|
213次组卷
|
3卷引用:贵州省顶效开发区顶兴学校2023-2024学年高三第三次月考化学试题
5 .  与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
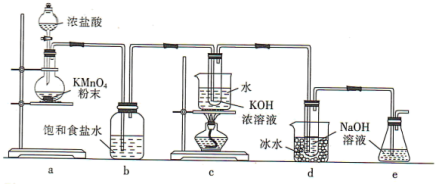
回答下列问题:
(1)a装置所用玻璃仪器的名称为______ (任意写一种);发生反应的离子方程式为____________ 。
(2)b装置的作用是____________ ;e装置的作用是____________ 。
(3)已知:c装置中得到的是 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。
①由此判断氯气与碱反应时,影响产物的因素有____________ 。
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时, 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为____________ 。
(4)取少量c、d装置中生成的 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显_______ 色。由此可推知,在碱性条件下, 的氧化能力
的氧化能力______ (填“>”或“<”)NaClO的氧化能力。
(5)该兴趣小组在40℃条件下,将一定量的 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为______ mol。
 与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
回答下列问题:
(1)a装置所用玻璃仪器的名称为
(2)b装置的作用是
(3)已知:c装置中得到的是
 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。①由此判断氯气与碱反应时,影响产物的因素有
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时,
 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为(4)取少量c、d装置中生成的
 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显 的氧化能力
的氧化能力(5)该兴趣小组在40℃条件下,将一定量的
 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为
您最近一年使用:0次
2022-07-12更新
|
113次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州2021-2022学年高二下学期期末质量检测化学试题
14-15高三上·云南昆明·期末
解题方法
6 . 如图是一个制取氯气并以氯气为原料进行特定反应的装置。

(l)A是氯气发生装置,写出其中的化学反应方程式___________ 。
(2)a仪器的名称为___________ 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HCl。写出D中反应的化学方程式_________ ,装置C的作用是__________ 。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为_______ 。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___________ (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是________ ;若发现装置B中该现象不明显,可能的原因是________ ;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_________________________ 。

(l)A是氯气发生装置,写出其中的化学反应方程式
(2)a仪器的名称为
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HCl。写出D中反应的化学方程式
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是
您最近一年使用:0次
7 . Cl2既是实验室中的一种重要试剂,又是工业生产中的一种重要原料。
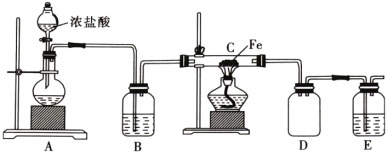
(1)实验室中利用铁屑与氯气反应制备 ,实验装置如图所示。
,实验装置如图所示。
①实验开始前,首先应________________________ 。
②盛浓盐酸的仪器的名称为________ 。
③装置A中观察到溶液紫色变浅,则发生反应的离子方程式为________________ ,还原剂为________ (填化学式,下同),氧化产物为________ 。
④每生成 时,消耗的
时,消耗的 为
为________ L (标准状况下),转移的电子数为________  。
。
(2)E中所盛装的试剂为________ (填“氢氧化钙”或“氢氧化钠”)溶液,原因是________________________ 。

(1)实验室中利用铁屑与氯气反应制备
 ,实验装置如图所示。
,实验装置如图所示。①实验开始前,首先应
②盛浓盐酸的仪器的名称为
③装置A中观察到溶液紫色变浅,则发生反应的离子方程式为
④每生成
 时,消耗的
时,消耗的 为
为 。
。(2)E中所盛装的试剂为
您最近一年使用:0次



