名校
1 . 从1869年俄国化学家门捷列夫编制出第一张元素周期表到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素“位-构-性”的关系,揭示了元素间的内在联系。下表列出①~⑧八种元素在周期表中的位置,回答下列问题:
(1)②③④的原子半径由大到小的顺序是_______ (填元素符号)。
(2)⑧的元素符号是_______ ,它的最高价含氧酸的分子式是_______ 。
(3)④能形成多种同素异形体,如_______ 、_______ 等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式_______ ,其中氧化剂是_______ 。
(5)⑥与⑦的简单氢化物更稳定的是_______ (填化学式)。
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为 ,镓的金属性比铝
,镓的金属性比铝_______ (填“强”或“弱”),其氢氧化物与盐酸反应的化学方程式为_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的元素符号是
(3)④能形成多种同素异形体,如
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式
(5)⑥与⑦的简单氢化物更稳定的是
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为
 ,镓的金属性比铝
,镓的金属性比铝
您最近一年使用:0次
2023-01-01更新
|
239次组卷
|
2卷引用:黑龙江省哈尔滨市2021-2022学年高一上学期期末学业质量检测化学试题
名校
2 . 现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知A的气态氢化物能与其最高价氧化物的水化物反应生成盐,B原子最外层电子数是其电子层数的3倍,C+和D3+的电子层结构相同,B与E属于同一主族。
(1)E在元素周期表中的位置是_______ 。
(2)上述元素形成的最高价氧化物的水化物碱性最强的物质是_______ (填化学符号)。
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:
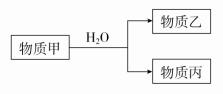
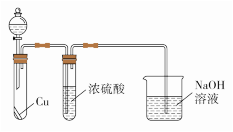
①若丙的水溶液是强碱性溶液,则甲为_______ 或_______ (填化学式)。
②若乙遇空气变为红棕色,物质丙为一种强酸,则物质甲与水反应的化学方程式为_______ 。有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确。用如上图装置进行实验时,分液漏斗中应加入_______ (填试剂名称)。实验过程中,浓硫酸中未发现有气体逸出且溶液变为红棕色,由此得出的结论是_______ 。
(4)某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如图转化关系图,图中A、B、C、D是由短周期元素组成的物质。并用于研究的性质及其变化。

请回答:若A为单质,其焰色试验为黄色,C为淡黄色固体。
①C中阴阳离子个数比为_______ 。
②下列说法正确的是_______ (填字母)。
a.A可经一步反应转化为D
b.B、C均可作呼吸面具的供氧剂
c.B、C、D均可与CO2反应
(5)若A为能使红色石蕊试纸变蓝的气体,C为红棕色气体。A与C反应生成E和水,E是空气中含量最多的气体,写出A与C发生反应的化学方程式_______ 。当生成19.6gE时,转移电子的物质的量为_______ mol。
(1)E在元素周期表中的位置是
(2)上述元素形成的最高价氧化物的水化物碱性最强的物质是
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:


①若丙的水溶液是强碱性溶液,则甲为
②若乙遇空气变为红棕色,物质丙为一种强酸,则物质甲与水反应的化学方程式为
(4)某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如图转化关系图,图中A、B、C、D是由短周期元素组成的物质。并用于研究的性质及其变化。

请回答:若A为单质,其焰色试验为黄色,C为淡黄色固体。
①C中阴阳离子个数比为
②下列说法正确的是
a.A可经一步反应转化为D
b.B、C均可作呼吸面具的供氧剂
c.B、C、D均可与CO2反应
(5)若A为能使红色石蕊试纸变蓝的气体,C为红棕色气体。A与C反应生成E和水,E是空气中含量最多的气体,写出A与C发生反应的化学方程式
您最近一年使用:0次
解题方法
3 . A、B、C、D、E五种元素中,A、B、C、D为原子序数依次增大的短周期主族元素,A的电子层数等于其最外层电子数且在同周期中A的原子半径最小,B、C、D元素的常见单质均为气体、其中B、C的单质是空气的主要成分,D与其他元素不在同一周期,E为常见使用量最大的金属,在一定条件下,A的单质可以分别与C、D的单质化合生成甲、乙。各物质间有如图转化关系,回答下列问题:.
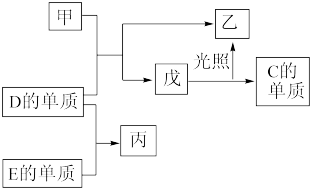
(1)D在元素周期表中的位置为____ 。
(2)写出B的单质的电子式:____ 。
(3)戊的分子中D元素的化合价为____ 。写出戊在光照条件下发生反应的化学方程式:____ 。
(4)A、B、C三种元素的原子半径从大到小的顺序为____ (用元素符号表示)。
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为____ 。
(6)丙具有很强的氧化性,丙的饱和溶液可以将E的单质溶解,试写出丙与E反应的离子方程式:____ 。

(1)D在元素周期表中的位置为
(2)写出B的单质的电子式:
(3)戊的分子中D元素的化合价为
(4)A、B、C三种元素的原子半径从大到小的顺序为
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为
(6)丙具有很强的氧化性,丙的饱和溶液可以将E的单质溶解,试写出丙与E反应的离子方程式:
您最近一年使用:0次
解题方法
4 . A、B、C、D.E五种元素中,A、B、C、D为原子序数依次增大的短周期主族元素,A的电子层数等于其最外层电子数且在同周期中A的原子半径最小, B、C、D元素的常见单质均为气体,其中B、C的单质是空气的主要成分,D与其他元素不在同一周期,E为常见使用量最大的金属。在一定条件下,A的单质可以分别与C、D的单质化合生成甲、乙。各物质间有如图转化关系,回答下列问题:
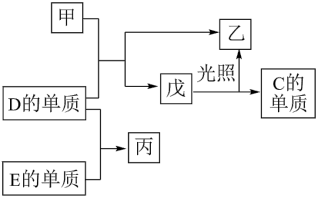
(1)D在元素周期表中的位置为_______ 。
(2)写出B的单质的电子式:_______ 。
(3)戊的分子中D元素的化合价为_______ 。写出戊在光照条件下发生反应的化学方程式:_______ 。
(4)A、B、C三种元素的原子半径从大到小的顺序为_______ (用元素符号表示)。
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为_______

(1)D在元素周期表中的位置为
(2)写出B的单质的电子式:
(3)戊的分子中D元素的化合价为
(4)A、B、C三种元素的原子半径从大到小的顺序为
(5)钠在C的气体中燃烧可以生成淡黄色固体,该物质中阳离子与阴离子的个数比为
您最近一年使用:0次
名校
5 . X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
(1)元素X在元素周期表中的位置是_______ ,其氢化物X2H4使Br2/CCl4溶液褪色的反应方程式为_______ 。
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是_______ 。
(3)汽车尾气净化器可使XO与YO两种有毒气体催化转化后排放,化学反应方程式为_______ 。
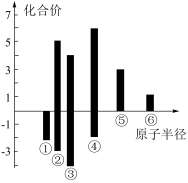
(4)上述六种元素原子半径与主要化合价的关系如图,其中X的单质与④最高价氧化物对应水化物浓溶液共热反应的还原产物为_______ 。
(5)为消除水体中含量过高的YQ ,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为
,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为_______ 。
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中原子半径最大的主族元素 |
Q | 最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是
(3)汽车尾气净化器可使XO与YO两种有毒气体催化转化后排放,化学反应方程式为
(4)上述六种元素原子半径与主要化合价的关系如图,其中X的单质与④最高价氧化物对应水化物浓溶液共热反应的还原产物为

(5)为消除水体中含量过高的YQ
 ,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为
,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为
您最近一年使用:0次
6 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
(1)表中某元素最高价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是____ ,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是____ (用离子符号表示)。②、④元素的最简单氢化物的沸点由高到低的顺序是____ 。(用化学式表示)
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该反应的离子方程式____ 。
(3)元素周期表中氧化性最强的元素是____ (写元素符号),该元素的单质和水反应的化学方程式为___ 。
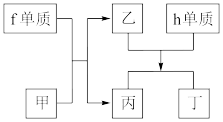
(4)以上元素组成的物质有下列框图中的转化关系,其中f为⑥的单质,甲为10电子微粒,h是⑨的单质。
①丁属于___ (选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式____ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | Ⅶ | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑨ | ⑧ | ||||
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该反应的离子方程式
(3)元素周期表中氧化性最强的元素是
(4)以上元素组成的物质有下列框图中的转化关系,其中f为⑥的单质,甲为10电子微粒,h是⑨的单质。

①丁属于
②请写出h单质与乙反应的化学方程式
您最近一年使用:0次
名校
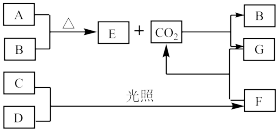
7 . a、b、c、d、e为五种短周期主族元素,原子序数依次递增。下图是a~e五种元素的单质及其化合物(或其溶液)的转化关系。已知A为金属单质,B、C、D是非金属单质,且在常温常压下都是气体,D常用于自来水的杀菌、消毒;化合物G的焰色试验呈黄色,化合物F通常状况下呈气态。请回答下列问题
(1)d在元素周期表中的位置位于___________ ,CO2的电子式为___________ 。
(2)e的单质与d的最高价氧化物对应的水化物反应的化学方程式是___________ 。
(3)Na2O2可在呼吸面具中作为氧气来源,假设每人每分钟消耗0.448LO2(标准状况),且所需的O2全部由Na2O2来提供,则某消防员工作1小时所需Na2O2的质量为___________ g
(4)b、c、d元素中,原子半径由小到大的顺序是___________ (填元素符号);c、d、e元素分别形成的简单离子中离子半径最小的是___________ (填离子符号)。
(5)b和e两元素相比较,非金属性较强是___________ (填元素符号),可以证明该结论的是___________ 。
A.e的气态氢化物比b的气态氢化物稳定
B.b氧化物对应的水化物的酸性弱于e氧化物对应的水化物的酸性
C.b的简单氢化物的沸点比e的氢化物沸点低
D.b和e形成的化合物中的化合价b为正价,e为负价

(1)d在元素周期表中的位置位于
(2)e的单质与d的最高价氧化物对应的水化物反应的化学方程式是
(3)Na2O2可在呼吸面具中作为氧气来源,假设每人每分钟消耗0.448LO2(标准状况),且所需的O2全部由Na2O2来提供,则某消防员工作1小时所需Na2O2的质量为
(4)b、c、d元素中,原子半径由小到大的顺序是
(5)b和e两元素相比较,非金属性较强是
A.e的气态氢化物比b的气态氢化物稳定
B.b氧化物对应的水化物的酸性弱于e氧化物对应的水化物的酸性
C.b的简单氢化物的沸点比e的氢化物沸点低
D.b和e形成的化合物中的化合价b为正价,e为负价
您最近一年使用:0次
2022-03-08更新
|
228次组卷
|
2卷引用:湖北省新高考联考协作体2021-2022学年高一下学期3月考试化学试题
名校
解题方法
8 . 元素X、Y、Z、M、N均为原子序数依次增大的短周期主族元素;R在地壳金属元素中的含量仅次于Z。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;N-、Z3+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)R在元素周期表中的位置是____________ ;Z3+的离子结构示意图是____________ 。
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式__________ ;M和N气态氢化物的稳定性大小比较为________ (用化学式和“>”“<”或“=”表示)。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________ .
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为_____________________________ 。
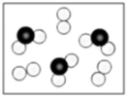
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是__________ (填化学式),示意图中转移电子的数目为______ 。


(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式_______________________ 。
(1)R在元素周期表中的位置是
(2)写出X、Y、N按原子个数之比1:1:1:形成的化合物的电子式
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
(4)Z元素的单质能与Y和R形成的化合物在一定条件下发生反应,同时放出大量的热,其反应的化学方程式为
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,在该转化关系中还原剂是



(6)由X、Y、M三种元素组成的离子,在水溶液中与H+和OH-均不能大量共存,还能和氯水反应,写出其与新制氯水反应的离子方程式
您最近一年使用:0次
2017-12-08更新
|
236次组卷
|
3卷引用: 安徽省舒城中学2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
9 . 一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题。

(1)氮元素在元素周期表中的位置____ ,N2的结构式是____ 。
(2)图中属于“氮的固定”的是____ (填字母,下同);转化过程中发生非氧化还原反应的是____ 。
(3)若“反应ⅰ”是在酸性条件下由NO 与Zn作用实现,则该反应的离子方程式为
与Zn作用实现,则该反应的离子方程式为____ 。

(1)氮元素在元素周期表中的位置
(2)图中属于“氮的固定”的是
(3)若“反应ⅰ”是在酸性条件下由NO
 与Zn作用实现,则该反应的离子方程式为
与Zn作用实现,则该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、E是原子序数依次增大并分属四个周期的前20号主族元素。B、C相邻且C原子的最外层电子数是内层电子数的3倍,D、E能形成化合物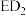 。
。
(1)B在元素周期表中的位置是___________ ,化合物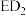 的电子式为
的电子式为___________ 。
(2)A与B、C形成的简单化合物的稳定性相对强弱为___________ (用化学式表示);化合物 中的化学键类型为
中的化学键类型为___________ 。
(3)科学研究发现化合物BC具有“扩张血管和增强免疫力、记忆力”的功能,故它成为当前生命科学研究中的“明星分子”。一定条件下该“明星分子”可转化为化合物B,C与另一种常见的红棕色气体,写出反应的化学方程式:___________ ,同温同体积条件下,该反应完全转化后,容器内反应前后的压强比为___________ 。
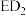 。
。(1)B在元素周期表中的位置是
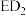 的电子式为
的电子式为(2)A与B、C形成的简单化合物的稳定性相对强弱为
 中的化学键类型为
中的化学键类型为(3)科学研究发现化合物BC具有“扩张血管和增强免疫力、记忆力”的功能,故它成为当前生命科学研究中的“明星分子”。一定条件下该“明星分子”可转化为化合物B,C与另一种常见的红棕色气体,写出反应的化学方程式:
您最近一年使用:0次



