名校
解题方法
1 . 下列说法不正确旳是
| A.浓硫酸和浓硝酸都具有强氧化性,都能把HCl气体氧化 |
| B.浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定 |
| C.同温同压下,两份相同质量的锌粉,分别与足量的稀硫酸和浓硫酸反应,产生气体的体积相同 |
| D.将SO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NH3则有沉淀生成 |
您最近半年使用:0次
2023-03-27更新
|
639次组卷
|
2卷引用:第五章 化工生产中的重要非金属元素 单元测试
2 . 久置的 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。
资料:i. 能与S反应生成
能与S反应生成 (黄色),
(黄色), 与酸反应生成S和
与酸反应生成S和 ;
;
ii.BaS、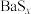 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;
iii.白色的 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。
将久置的 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
(1)推测 变质的产物含有
变质的产物含有 ,实验证据是
,实验证据是_______ 。
(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。
途径二: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。
途径三: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……
① 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是_______ 。
②请将途径三补充完全:白色沉淀由_______ 。
(3)为检验 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:
①取黄色溶液,向其中滴加 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是_______ 。
②改进实验,方案和现象如下:
实验一: 和
和 混合溶液
混合溶液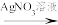 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)
实验二:
a.实验一的目的是_______ 。
b.试剂1是_______ ,试剂2是_______ 。
(4)检验 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?_______ 。说明理由:_______ 。
 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。资料:i.
 能与S反应生成
能与S反应生成 (黄色),
(黄色), 与酸反应生成S和
与酸反应生成S和 ;
;ii.BaS、
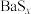 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;iii.白色的
 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。将久置的
 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。(1)推测
 变质的产物含有
变质的产物含有 ,实验证据是
,实验证据是(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由
 与稀硫酸反应产生。
与稀硫酸反应产生。途径二:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。途径三:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……①
 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是②请将途径三补充完全:白色沉淀由
(3)为检验
 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:①取黄色溶液,向其中滴加
 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是②改进实验,方案和现象如下:
实验一:
 和
和 混合溶液
混合溶液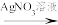 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)实验二:

a.实验一的目的是
b.试剂1是
(4)检验
 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
您最近半年使用:0次
名校
3 . 部分含硫物质的分类与相应的化合价关系如图,下列推断不合理的是
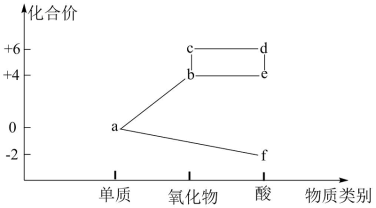

| A.b可与f反应生成a |
| B.b既可被氧化,也可被还原 |
| C.酸雨包括e→d的转化 |
| D.d的浓溶液与Cu反应可生成c |
您最近半年使用:0次
2021-12-22更新
|
2026次组卷
|
14卷引用:第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)
第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】广东省广州市2021-2022学年高三上学期12月调研考试化学试题(已下线)周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)化学-2022年高考考前押题密卷(广东卷)(已下线)第15讲 硫酸-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)黑龙江省牡丹江市第三高级中学2022-2023学年高一下学期期中考试化学试题广东省湛江市坡头区第一中学2022-2023学年高一下学期期中考试化学试题江苏省苏州市2022-2023学年高一上学期12月期末考试化学试题(已下线)考点巩固卷04 非金属及其化合物(4大考点60题)?-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题07 硫及含硫化合物 环境保护-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)河南省实验中学2023-2024学年高一上学期月考 化学试卷云南省开远市第一中学校2023-2024学年高一下学期3月月考化学试题
4 . Na2SO3中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、H2SO4、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(2)要证明Na2SO3具有氧化性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有___________ ,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)要证明Na2SO3具有还原性,应选用的试剂有
(2)要证明Na2SO3具有氧化性,应选用的试剂有
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有
您最近半年使用:0次
2021-12-05更新
|
980次组卷
|
3卷引用:第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)
第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)4.2.1 含硫物质之间的转化-2021-2022学年高一化学10分钟课前预习练(苏教版2019必修第一册)(已下线)5.1.3 不同价态含硫物质的转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)
名校
解题方法
5 . 某学生做如下实验:第一步,在淀粉KI溶液中滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝:第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液、蓝色逐渐消失,并检测到有硫酸钠生成。下列叙述中该同学对实验原理的解释和所得结论不正确 的是
A.氧化性:HClO>I2>SO |
| B.若将足量Na2SO3溶液加入氯水中,氯水褪色 |
| C.蓝色消失的原因是Na2SO3溶液具有漂白性 |
| D.淀粉KI溶液变蓝是因为I-被HClO氧化为I2,I2遇淀粉变蓝 |
您最近半年使用:0次
2021-04-12更新
|
536次组卷
|
26卷引用:2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷
2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷(已下线)2012届广西桂林十八中高三上学期第三次月考化学试卷(已下线)2011-2012学年山东省济宁汶上一中高一下学期3月月考化学试卷(已下线)2013届山东省德州市跃华学校高三12月月考化学试卷(已下线)2012-2013学年江西省南昌市第二中学高一下学期期中考试化学试卷2015届山东省枣庄二中高三元月模拟测试化学试卷2015-2016学年河北省正定中学高一上学期期末化学试卷黑龙江省哈尔滨市122中学2017-2018学年高一上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第一次调研考试化学试题河北省隆化县存瑞中学2019届高三上学期第一次质检化学试题贵州省遵义育新高级中学2018-2019学年高一上学期11月考试化学试题(已下线)【新东方】2020--98安徽省怀宁县新安中学2019-2020学年高二下学期期末考试化学试题安徽省合肥市肥东县第二中学2020-2021学年高一上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP404】【化学】(已下线)【浙江新东方】89.福建省莆田第一中学2020-2021学年高一上学期期末考试化学试题浙江省之江教育评价2020-2021学年高一下学期返校联考化学试题广东省梅州市(梅州、蕉中、虎中)三校2020-2021学年高一下学期4月联考化学试题(已下线)【浙江新东方】在线化学61高一下广东省广州越秀三校2021-2022学年高一下学期期中联考化学试题福建省莆田第四中学2021-2022学年高一上学期期末考试化学试题河南省郑州市第七高级中学2022-2023 学年高一上学期期末考试化学试题广西钦州市2022-2023学年高一上学期第2次教学质量监测化学试卷广东省汕头市实验学校2022-2023 学年高—下学期第一阶段质量检测化学试题山东省枣庄市第三中学2023-2024学年高一上学期1月期末模拟化学试题
19-20高一·全国·课后作业
解题方法
6 . 某废水中含有一定量的Na+、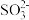 ,可能含有
,可能含有 ,某研究小组欲测定其中
,某研究小组欲测定其中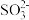 的浓度,设计如图所示的实验方案:
的浓度,设计如图所示的实验方案:
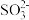 ,可能含有
,可能含有 ,某研究小组欲测定其中
,某研究小组欲测定其中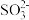 的浓度,设计如图所示的实验方案:
的浓度,设计如图所示的实验方案:
| A.0.1mol/L KMnO4(H2SO4酸化)溶液 | B.0.5mol/L NaOH溶液 |
| C.新制氯水 | D.KI溶液 |
您最近半年使用:0次
2020-09-23更新
|
267次组卷
|
5卷引用:第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)
(已下线)第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)高一必修第一册(鲁科2019)第3章 第2节 硫的转化高一必修第一册(苏教2019)专题4 第一单元 含硫化合物的性质4山东省临朐县实验中学2020-2021学年高一1月阶段性测试化学试题5.1.4 不同价态含硫物质的转化 课堂例题
20-21高一·全国·单元测试
解题方法
7 . 某待测溶液(阳离子为Na+)中可能含有 、
、 、
、 、Cl-、Br-、
、Cl-、Br-、 、
、 、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
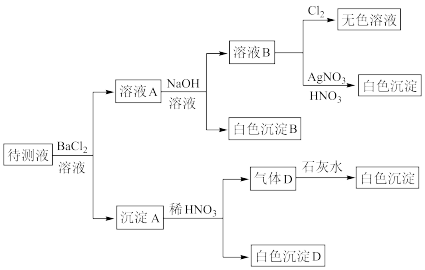
(1)待测液中是否含有 、
、 :
:_____________________ 。
(2)沉淀B的化学式为__________ ;生成沉淀B的离子方程式为___________________________ 。
(3)根据以上实验,待测液中肯定没有的离子是_____________________ ;肯定存在的离子还有_____________________ 。
 、
、 、
、 、Cl-、Br-、
、Cl-、Br-、 、
、 、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
、S2-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答下列问题:
(1)待测液中是否含有
 、
、 :
:(2)沉淀B的化学式为
(3)根据以上实验,待测液中肯定没有的离子是
您最近半年使用:0次
名校
8 . 下列现象或事实不能用同一原理解释的是
| A.浓硝酸和氯水用棕色试剂瓶保存 | B.硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C.SO2 和 Na2SO3 溶液都能使氯水褪色 | D.常温下铁和铂都不溶于浓硝酸 |
您最近半年使用:0次
2020-06-13更新
|
1258次组卷
|
34卷引用:2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)
2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2014-2015辽宁省实验分校高一上学期期末化学(理)试卷2016届山东省山东师范大学附属中学高三上学期一模化学试卷2016届陕西省安康长兴学校高三上学期10月月考化学试卷2016届河南省陕州中学高三上学期第一次月考化学试卷2016届吉林省东北师大附属中学高三上学期第二次模拟化学试卷2016届山东省菏泽一中高三上学期12月月考化学试卷2015-2016学年河南省新乡市延津一中高一下开学考试化学试卷2015-2016学年河南省新乡市延津一中高一下学期开学化学试卷2016-2017黑龙江牡丹江第一高级中学高一上期末化学卷山东省新泰二中2020届高三上学期第一阶段性测试化学试题北京五中2019-2020学年度高一第二学期第一次阶段性考试试卷化学试题四川省内江市第六中学2019-2020学年高一下学期入学考试化学B试题四川省内江市第六中学2019-2020学年高一下学期入学考试化学C试题四川省威远县连界一中2019-2020学年高一4月测试化学试题内蒙古赤峰二中2019-2020学年高一下学期第一次月考化学试题四川隆昌市第二中学2019-2020学年高一下学期4月测试化学试题湖北省黄梅一中2019--2020学年高一下学期期中考试化学试题安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高一下学期期中考试(第二次月考)化学试题江西省上饶中学2019-2020学年高二下学期期末考试化学试题安徽省六安中学2019-2020学年高一下学期期中考试化学试题内蒙古通辽市奈曼旗实验中学2018-2019学年高一下学期期中考试化学试题人教版2019必修第二册 第五章 第二节 第3课时 硝酸 酸雨及防治四川省峨眉第二中学校2021-2022学年高一下学期3月月考化学试题湖北省沙市中学2021-2022学年高一下学期期中考试化学试题四川省遂宁中学校2019-2020学年高一下学期第二次月考化学试题云南省丽江市2021-2022学年高一上学期9月测试化学试题 湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(B卷)河南省巩义市第二高级中学2022-2023学年高一下学期阶段测试(6月)化学试题广东省湛江市第二中学2022-2023学年高一下学期期末考试化学试题河北省衡水市武强学校2023-2024学年高三上学期开学考试化学试题天津市第二十中学2023-2024学年高一下学期3月考试化学试题
名校
解题方法
9 . 有一白色粉末X,对X检验时,所做实验和现象为:
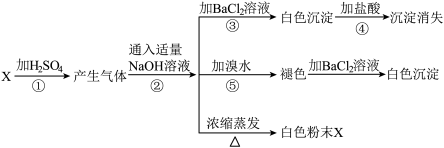
(1)写出X的化学式___ 。
(2)在①步反应中H2SO4的作用是___ 。
①在水溶液中电离,并呈强酸性 ②具有高沸点、难挥发性 ③浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性
(3)写出④、⑤两步反应的离子方程式:___ 、___ 。

(1)写出X的化学式
(2)在①步反应中H2SO4的作用是
①在水溶液中电离,并呈强酸性 ②具有高沸点、难挥发性 ③浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性
(3)写出④、⑤两步反应的离子方程式:
您最近半年使用:0次
10 . 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其发扬进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=_____________ 。
(2)反应Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O中的还原剂为_________ 。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42- 。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:_____________ ;
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=
(2)反应Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O中的还原剂为
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42- 。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3moL
 L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液。| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |  |
| 步骤2: | |
| 步骤3: |
您最近半年使用:0次
2016-12-09更新
|
183次组卷
|
7卷引用:高一必修第一册(鲁科2019)第3章 章末综合检测卷



