名校
解题方法
1 . 钠碱法的启动吸收剂为 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。
(1)工业上先用 溶液吸收
溶液吸收 ,再用
,再用 使
使 再生:NaOH溶液
再生:NaOH溶液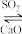 Na2SO3。使
Na2SO3。使 再生的原理是
再生的原理是___________ 。(用化学方程式表示)
(2)常温下进行“钠碱法”的模拟实验。用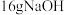 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为___________  (折算成标准状况)。若实验时只吸收了
(折算成标准状况)。若实验时只吸收了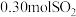 ,则反应后的吸收液中,溶质的组成为:
,则反应后的吸收液中,溶质的组成为:___________ 。(写出溶质组成和每种溶质的物质的量)
(3)若用碱液吸收工业尾气中的 后,得到等物质的量浓度的
后,得到等物质的量浓度的 和
和 溶液。继续向溶液中滴入几滴
溶液。继续向溶液中滴入几滴 溶液变浑浊,请写出发生反应的离子方程式
溶液变浑浊,请写出发生反应的离子方程式___________ 。
 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。(1)工业上先用
 溶液吸收
溶液吸收 ,再用
,再用 使
使 再生:NaOH溶液
再生:NaOH溶液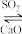 Na2SO3。使
Na2SO3。使 再生的原理是
再生的原理是(2)常温下进行“钠碱法”的模拟实验。用
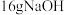 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为 (折算成标准状况)。若实验时只吸收了
(折算成标准状况)。若实验时只吸收了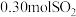 ,则反应后的吸收液中,溶质的组成为:
,则反应后的吸收液中,溶质的组成为:(3)若用碱液吸收工业尾气中的
 后,得到等物质的量浓度的
后,得到等物质的量浓度的 和
和 溶液。继续向溶液中滴入几滴
溶液。继续向溶液中滴入几滴 溶液变浑浊,请写出发生反应的离子方程式
溶液变浑浊,请写出发生反应的离子方程式
您最近一年使用:0次
2 . I.某地出现硫酸型酸雨,现采集了一份雨水样品,其pH随时间变化如下:
(1)用化学方程式表示雨水样品pH变化的原因_______ 。
(2)如将刚采集到的雨水样品与自来水混合(自来水含氯气), pH将_______ (选填“变大”、 “变小”、 “不变”。反应的方程式为_______ 。
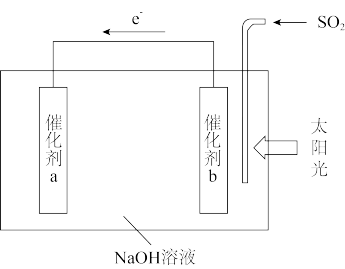
(3)我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。产生标况下2.24LH2时,脱除SO2_______ g。
II.如图是土壤中发生的氮循环示意图,回答下列问题:
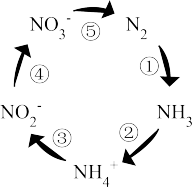
(4)固氮过程的序 号是_______ 。人工固氮的反应方程式为_______ 。
(5)为了消除NOx对大气的污染,工业上通常利用NH3还原的方法实现无害化处理,现有 NO2和NO的混合气体3L,可用相同状况下3.5L的NH3恰好使其完全转化为N2,则混合气体中NO2和NO体积之比为_______ 。
| 测试时间/h | 0 | 2 | 4 | 6 |
| pH | 4.73 | 4.55 | 4.42 | 4.41 |
(2)如将刚采集到的雨水样品与自来水混合(自来水含氯气), pH将
(3)我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。产生标况下2.24LH2时,脱除SO2

II.如图是土壤中发生的氮循环示意图,回答下列问题:

(4)固氮过程的序 号是
(5)为了消除NOx对大气的污染,工业上通常利用NH3还原的方法实现无害化处理,现有 NO2和NO的混合气体3L,可用相同状况下3.5L的NH3恰好使其完全转化为N2,则混合气体中NO2和NO体积之比为
您最近一年使用:0次
名校
解题方法
3 . 硫、氮元素是高中化学学习的两种重要非金属元素,其价类二维图分别如图所示:
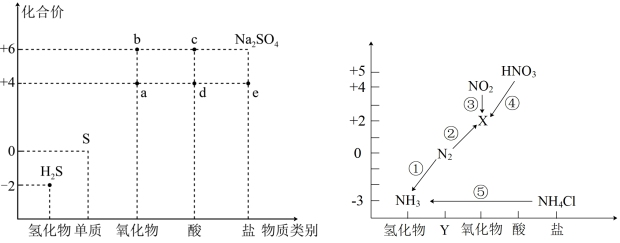
(1)图中物质“d”的化学式是_______ ;“Y”代表的物质类别是_______ 。
(2)将足量的a气体通入下列溶液中,始终没有明显反应现象的是_______(填标号)。
(3)写出反应③的离子方程式:_______ 。
(4)H2S水溶液的俗名为_______ 。d的溶液与H2S发生反应的化学方程式:_______ 。
(5)已知e为钾元素的正盐,且能被硫酸酸化的K2Cr2O7氧化为K2SO4,Cr2O 被还原为Cr3+,写出此反应的化学方程式:
被还原为Cr3+,写出此反应的化学方程式:_______ 。
(6)图为合成氨以及氨氧化制硝酸的流程示意图:
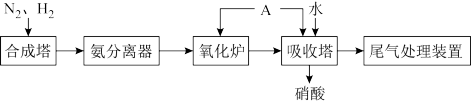
为了防止环境污染,用NaOH溶液进行尾气处理,若尾气能完全被吸收,则尾气中NO2与NO的体积比的范围是_______ 。

(1)图中物质“d”的化学式是
(2)将足量的a气体通入下列溶液中,始终没有明显反应现象的是_______(填标号)。
| A.Ba(NO3)2溶液 | B.CaCl2溶液 | C.H2O2溶液 | D.Na2CO3溶液 |
(4)H2S水溶液的俗名为
(5)已知e为钾元素的正盐,且能被硫酸酸化的K2Cr2O7氧化为K2SO4,Cr2O
 被还原为Cr3+,写出此反应的化学方程式:
被还原为Cr3+,写出此反应的化学方程式:(6)图为合成氨以及氨氧化制硝酸的流程示意图:

为了防止环境污染,用NaOH溶液进行尾气处理,若尾气能完全被吸收,则尾气中NO2与NO的体积比的范围是
您最近一年使用:0次
4 . 某溶液中含有 、Na+、
、Na+、 、
、 、
、 、
、 、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
(1)离子浓度保持不变的是___________ ;
(2)离子浓度减小的是___________ ;
(3)离子浓度增大的是___________ ;
(4)其中发生的非氧化还原反应有___________ (用离子方程式表示);
(5)发生的氧化还原反应的有___________ (用离子方程式表示);。
 、Na+、
、Na+、 、
、 、
、 、
、 、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:
、Cl-、K+等八种离子,向其中加入Na2O2粉末,则:(1)离子浓度保持不变的是
(2)离子浓度减小的是
(3)离子浓度增大的是
(4)其中发生的非氧化还原反应有
(5)发生的氧化还原反应的有
您最近一年使用:0次
5 . I.利用下图装置制备 ,并研究
,并研究 的性质。
的性质。
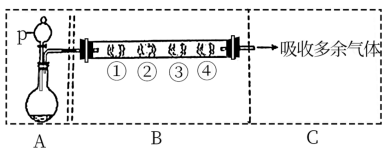
(1)A装置利用亚硫酸钠和硫酸反应制备 ,写出化学方程式
,写出化学方程式_______ 。
(2)填写下表
(3) 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性_______ (填“增强”“减弱”“不变”)原因是_______ (用化学方程式表示)。
II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(4)上述流程中,加入 后,发生反应的化学方程式为
后,发生反应的化学方程式为_______ 。
(5)亚硫酸钠粗品中含有少量 ,原因是
,原因是_______ 。
 ,并研究
,并研究 的性质。
的性质。
(1)A装置利用亚硫酸钠和硫酸反应制备
 ,写出化学方程式
,写出化学方程式(2)填写下表
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色 | ||
体现 的性质 的性质 |
(3)
 和氯气按照体积比
和氯气按照体积比 通入水中,溶液的漂白性
通入水中,溶液的漂白性II.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
(4)上述流程中,加入
 后,发生反应的化学方程式为
后,发生反应的化学方程式为(5)亚硫酸钠粗品中含有少量
 ,原因是
,原因是
您最近一年使用:0次
6 . 酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。SO2、NOx是形成酸雨的主要物质,研究SO2、NOx等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
(1)酸雨是指pH_______ 的雨水。
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:① ;②
;②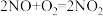 ;③
;③_______ 。
(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是_______ 。
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为_______ 。
③用氨水将SO2转化为NH4HSO3,再氧化成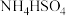 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是_______ 、_______ (用离子方程式表示)。
(1)酸雨是指pH
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:①
 ;②
;②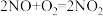 ;③
;③(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为
③用氨水将SO2转化为NH4HSO3,再氧化成
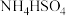 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是
您最近一年使用:0次
2021-02-07更新
|
171次组卷
|
2卷引用:山西省大同市灵丘一中、广灵一中2020-2021学年高一下学期期中联考化学试题
名校
解题方法
7 . 硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,请分析此图并回答有关问题。
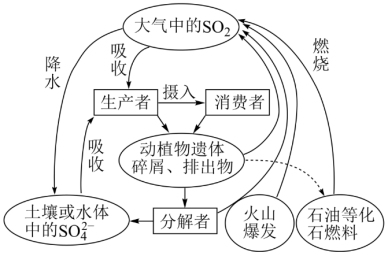
(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是________ 。
(2)分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是_______ 。
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是_________________ ,收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是________________ 。(用化学方程式表示)
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______ (填化学式)。

(1)氮循环和硫循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是
| 选项 | 比较 | 氮循环 | 硫循环 |
| A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
| B | 氮循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
| C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
| D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
A.H2S分子很稳定,受热难分解
B. H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S中硫元素为-2价,因此H2S只有还原性,没有氧化性
E.H2S是一种无色臭鸡蛋气味的有毒气体
(3)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。检验某次降雨是否为酸雨的方法是
(4)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是
您最近一年使用:0次



