1 . 工业上用辉铜矿(主要成分是Cu2S,还含有少量SiO2)制备CuCl的工艺流程如下:
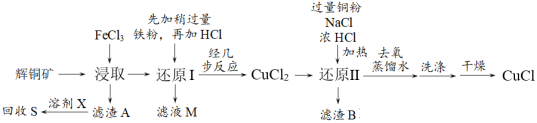
查阅资料得以下信息:CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇,在潮湿的空气中易水解氧化为碱式氯化铜。
回答以下问题:
(1)已知铜是29号元素,最外层电子数为1,画出铜的原子结构示意图_______ 。
(2)滤渣A的成分是_______ 。
(3)要回收滤渣A中的硫单质,溶剂X可以选择_______。
(4)写出浸取时发生反应的离子方程式_______ 。
(5)检验滤液M是否氧化变质,应加入的最佳试剂为_______ 。
(6)滤液M与试剂Y发生反应后,所得产物可以循环利用,试剂Y为_______ 。
(7)洗涤时选择的最佳试剂是_______。
(8)CuSO4与Na2SO3溶液、NaCl溶液混合加热,也可以得到CuCl沉淀,写出反应的离子方程式_______ 。

查阅资料得以下信息:CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇,在潮湿的空气中易水解氧化为碱式氯化铜。
回答以下问题:
(1)已知铜是29号元素,最外层电子数为1,画出铜的原子结构示意图
(2)滤渣A的成分是
(3)要回收滤渣A中的硫单质,溶剂X可以选择_______。
| A.水 | B.酒精 | C.CS2 | D.稀H2SO4 |
(5)检验滤液M是否氧化变质,应加入的最佳试剂为
(6)滤液M与试剂Y发生反应后,所得产物可以循环利用,试剂Y为
(7)洗涤时选择的最佳试剂是_______。
| A.稀盐酸 | B.酒精 | C.稀HNO3 | D.稀H2SO4 |
您最近半年使用:0次
名校
解题方法
2 . 某溶液中可能含有浓度均为0.5mol/L的K+、Na+、Fe2+、Fe3+、SO 、SO
、SO 中的几种离子。根据下列实验操作与现象,推测合理的是
中的几种离子。根据下列实验操作与现象,推测合理的是
 、SO
、SO 中的几种离子。根据下列实验操作与现象,推测合理的是
中的几种离子。根据下列实验操作与现象,推测合理的是| 实验步骤 | 实验现象 | |
| Ⅰ | 向该溶液中加酸性高锰酸钾溶液 | 紫色褪去 |
| Ⅱ | 向该溶液中加氯化钡溶液 | 产生难溶于水的沉淀 |
A.若溶液中有SO ,则有Fe2+ ,则有Fe2+ | B.溶液中可能有Fe3+ |
C.若溶液中有SO ,则一定有Fe3+ ,则一定有Fe3+ | D.SO 、SO 、SO 可能同时存在于溶液中 可能同时存在于溶液中 |
您最近半年使用:0次
3 . 根据下列实验操作和现象所得到的实验结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色 | 该废铁屑中不含三价铁的化合物 |
| B | 向Na2SO3溶液中先加入Ba(NO3)2溶液,生成白色沉淀,然后再加入稀盐酸,沉淀不溶解 | Na2SO3溶液已经变质 |
| C | 取少量Mg(OH)2悬浊液,向其中滴加适量CH3COONH4浓溶液,Mg(OH)2溶解 | CH3COONH4溶液呈酸性 |
| D | 在CuSO4溶液中加入KI溶液,再加入苯,振荡,上层呈紫红色,下层有白色沉淀产生 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-12-31更新
|
365次组卷
|
3卷引用:重庆市缙云教育联盟2021-2022学年高三上学期第一次诊断性检测化学试题
解题方法
4 . 无机研究开创绝不无“钴”的时代,例如: 是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为
是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:
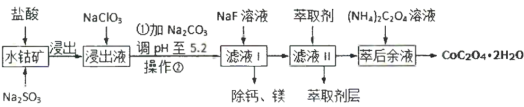
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②酸性条件下, 不会氧化
不会氧化 ,
, 转化为
转化为 ;
;
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
回答下列问题:
(1)酸浸过程中, 参与反应的离子方程式为:
参与反应的离子方程式为:___________ 。
(2) 的作用是
的作用是___________ 。
(3)操作②的名称是___________ ,在实验室完成此操作所用到的玻璃仪器有:___________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是___________ (至少答两点);其使用的适宜pH范围是___________ (填字母代号)。
A.1.0~2.0 B.3.0~3.5 C.4.5~5.0
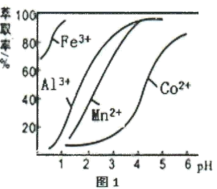
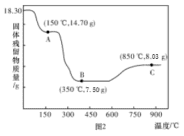
(5) 热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是
热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是___________ 。
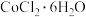 是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为
是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:
已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②酸性条件下,
 不会氧化
不会氧化 ,
, 转化为
转化为 ;
;③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
回答下列问题:
(1)酸浸过程中,
 参与反应的离子方程式为:
参与反应的离子方程式为:(2)
 的作用是
的作用是(3)操作②的名称是
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是
A.1.0~2.0 B.3.0~3.5 C.4.5~5.0


(5)
 热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是
热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是
您最近半年使用:0次
5 . 下列离子检验说法正确的是
A.某溶液中滴加Ba(NO3)2溶液产生白色沉淀,该溶液中有SO |
B.某溶液中滴加HNO3溶液产生气体,该溶液中一定有CO |
| C.某溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液褪色,该溶液一定有Fe2+ |
| D.某溶液中滴加KSCN溶液,溶液变为红色,该溶液中一定有Fe3+ |
您最近半年使用:0次
名校
解题方法
6 . 为了检验某溶液中是否含有硫酸根离子,下列操作最合理的是
| A.先加硝酸钡溶液产生白色沉淀,再加盐酸,白色沉淀不溶解则原溶液中含有硫酸根 |
| B.先加硝酸钡溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解则原溶液中含有硫酸根 |
| C.先用盐酸酸化无明显现象,再加氯化钡溶液,若有白色沉淀则原溶液中含有硫酸根 |
| D.先用硝酸酸化无明显现象,再加氯化钡溶液,若有白色沉淀则原溶液中含有硫酸根 |
您最近半年使用:0次
2021-04-08更新
|
242次组卷
|
3卷引用:重庆市巴蜀中学2020-2021学年高一3月月考化学试题
重庆市巴蜀中学2020-2021学年高一3月月考化学试题(已下线)期中01-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)黑龙江省漠河市高级中学2021-2022学年高一上学期第一次月考化学试题
名校
解题方法
7 . 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知: (橙色) +H2O
(橙色) +H2O
 (黄色) + 2H+
(黄色) + 2H+
(1)进行实验ⅰ和ⅱ:
①用离子方程式表示饱和Na2SO3溶液pH约为9的原因:______________________ 。
②用离子方程式解释i中现象:______________________ 。
(2)继续进行实验ⅲ:
为了说明产生上述现象的原因,补充实验ⅳ:
向2 mL蒸馏水中滴加pH=2的0.05 mol/L K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验ⅳ的目的是______________________ 。
②用化学平衡移动原理解释iii中现象:______________________ 。
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬( VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬( VI)盐溶液不发生氧化还原反应;
b.______________________ 。
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是______________ 。
已知:
 (橙色) +H2O
(橙色) +H2O
 (黄色) + 2H+
(黄色) + 2H+(1)进行实验ⅰ和ⅱ:
| 序号 | 操作 | 现象 |
| ⅰ | 向2 mLpH=2的0.05 mol/LK2Cr2O7的橙色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴 | 溶液变绿色(含Cr3+) |
| ⅱ | 向2 mLpH=8的0.1 mol/L的K2CrO4黄色溶液中滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
②用离子方程式解释i中现象:
(2)继续进行实验ⅲ:
| 序号 | 操作 | 现象 |
| ⅲ | 向2 mL饱和Na2SO3溶液中滴加pH=2的0.05 mol/LK2Cr2O7的橙色溶液3滴 | 溶液变黄色 |
向2 mL蒸馏水中滴加pH=2的0.05 mol/L K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验ⅳ的目的是
②用化学平衡移动原理解释iii中现象:
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬( VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬( VI)盐溶液不发生氧化还原反应;
b.
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
您最近半年使用:0次
2020-12-29更新
|
468次组卷
|
5卷引用:重庆市第三十二中学2020-2021学年高二上学期期末考试化学试题
8 . 有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是
| A.Na2SO3已部分被空气中的氧气氧化 |
| B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| C.题中操作可证明Na2SO3溶液是否被氧化 |
| D.此实验不能确定Na2SO3是否部分被氧化 |
您最近半年使用:0次
2016-12-09更新
|
98次组卷
|
2卷引用:重庆两江新区西大附中2021-2022学年高二上学期(秋季)开学考试化学试题



