21-22高一·全国·课时练习
1 . Na2SO3中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、H2SO4、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(2)要证明Na2SO3具有氧化性,应选用的试剂有___________ ,看到的现象是___________ ,反应的离子方程式为___________ 。
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有___________ ,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)要证明Na2SO3具有还原性,应选用的试剂有
(2)要证明Na2SO3具有氧化性,应选用的试剂有
(3)证明H2SO3的酸性小于H2SO4,选用的试剂有
您最近一年使用:0次
2 . 亚硫酸的性质
(1)弱酸性:___________ (电离方程式)。
(2)不稳定性:___________ 。
(3)强还原性(与O2、H2O2反应):___________ 。
(4)弱氧化性(与H2S反应):___________ 。
(1)弱酸性:
(2)不稳定性:
(3)强还原性(与O2、H2O2反应):
(4)弱氧化性(与H2S反应):
您最近一年使用:0次
解题方法
3 . 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如图。下列说法错误的是
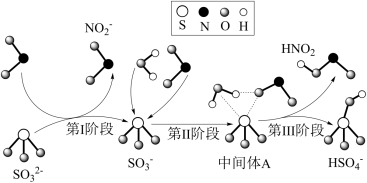

A.氧化性:NO2>SO ,还原性:SO ,还原性:SO >HNO2 >HNO2 |
B.第II、III阶段总的化学方程式为:SO +H2O+NO2=HNO2+HSO +H2O+NO2=HNO2+HSO |
| C.NO2在所有过程中都是被还原 |
| D.上述反应过程中,S的成键数目保持不变 |
您最近一年使用:0次
2022-11-20更新
|
1296次组卷
|
3卷引用:山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题
山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题(已下线)专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)山东日照市莒县一中2022-2023学年高一下学期3月月考化学试题
2022·山东淄博·三模
名校
4 . 在“价一类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,相关推断不合理的是
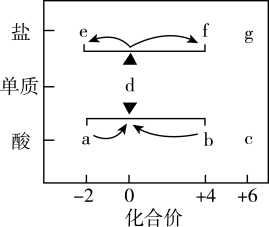

| A.b、d、f既具有氧化性又具有还原性 |
| B.硫酸型酸雨的形成过程涉及b到c的转化 |
| C.d与c在一定条件下反应可生成b或a |
D.d在加热条件下与强碱溶液反应生成e和f,且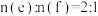 |
您最近一年使用:0次
2022-05-31更新
|
631次组卷
|
6卷引用:考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第13讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)上海市金山区2022-2023学年高三第一次质量调研(一模)化学试题山东省淄博市2022届高三三模化学试题(已下线)第4讲 浓硫酸 不同价态含硫物质的转化福建省德化第一中学2023-2024学年高三上学期第一次月考化学试题
5 . 亚硫酸钠中+4价的硫既有氧化性又有还原性。现有试剂:氯水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液。
(1)要证明亚硫酸溶液具有还原性,应选用什么试剂____ ?会观察到什么现象____ ?写出反应的离子方程式____ 。
(2)要证明亚硫酸钠溶液具有氧化性,应选用什么试剂____ ?会观察到什么现象____ ?写出反应的离子方程式____ 。
(3)如何通过实验证明亚硫酸钠已被氧化____ ?
(1)要证明亚硫酸溶液具有还原性,应选用什么试剂
(2)要证明亚硫酸钠溶液具有氧化性,应选用什么试剂
(3)如何通过实验证明亚硫酸钠已被氧化
您最近一年使用:0次
21-22高一下·安徽·阶段练习
6 . 探究亚硫酸(溶液中存在大量 分子)的性质,进行如下实验。
分子)的性质,进行如下实验。
由上述实验所得亚硫酸性质及对应的解释错误的是
 分子)的性质,进行如下实验。
分子)的性质,进行如下实验。| 实验 | 装置 | 试剂a | 现象 |
| ① |  | 氯水 | 氯水褪色 |
| ② |  溶液(含酚酥) 溶液(含酚酥) | 溶液褪色,产生白色沉淀 | |
| ③ |  、 、 溶液 溶液 | 产生白色沉淀 | |
| ④ |  溶液 溶液 | 溶液出现乳白色浑浊 |
A.H2SO3溶液使氯水褪色: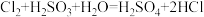 |
B.H2SO3有酸性: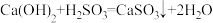 |
C.H2SO3有还原性: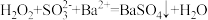 |
D.H2SO3有氧化性: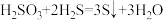 |
您最近一年使用:0次
2022-05-15更新
|
159次组卷
|
3卷引用:第15练 实验综合题与无机综合题-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
(已下线)第15练 实验综合题与无机综合题-2022年【暑假分层作业】高一化学(人教版2019必修第二册)安徽省示范高中培优联盟2021-2022学年高一下学期春季联赛考试化学试题云南省楚雄天人中学2021-2022学年高二6月月考化学(A)试题
7 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
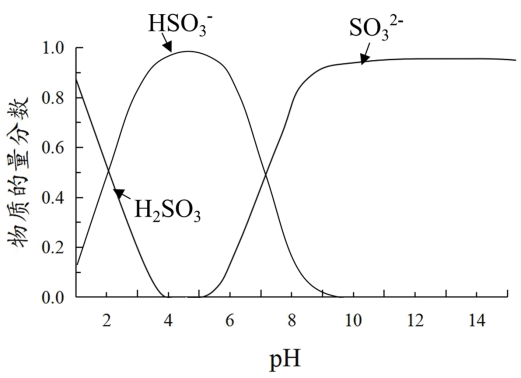
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1789次组卷
|
6卷引用:北京市丰台区2022届高三二模化学试题
北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题天天练6-10
21-22高三上·江西宜春·阶段练习
名校
解题方法
8 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
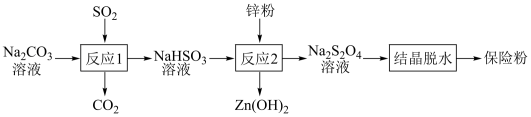
下列说法错误的是

下列说法错误的是
| A.反应1说明酸性:H2SO3>H2CO3 |
| B.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2 |
| C.反应2最好在无氧条件下进行 |
| D.反应1结束后,可用盐酸酸化的BaCl2溶液检验NaHSO3是否被氧化 |
您最近一年使用:0次
2021-11-04更新
|
803次组卷
|
5卷引用:专题40 硫的含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
(已下线)专题40 硫的含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省安康市2022-2023学年高二上学期11月期中化学试题(已下线)3.2.2 硫酸 不同价态硫元素间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)陕西省安康市2022-2023学年高二下学期开学摸底考试化学试题江西省奉新县第一中学2021-2022学年上学期高三第一次月考化学试题
2022·湖南岳阳·二模
9 . 已知NH4CuSO3与足量的1mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是
| A.NH4CuSO3中硫元素被还原 |
| B.刺激性气味的气体是二氧化硫或氨气 |
| C.该反应中硫酸既体现了酸性又体现了氧化性 |
| D.反应中每消耗1molNH4CuSO3,转移的电子数约为3.01×1023 |
您最近一年使用:0次
10 . 亚硫酸钠(Na2SO3)是印染工业中常用的脱氧剂和漂白剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:___________
(2)SO2可以与H2S反应,请写出其化学方程式:___________ 。
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(4)(Ga)与A1同主族,化学性质相似,是制造半导体材料氮化镓的重要原料,其中电解NaGaO2是获得Ga单质的重要方法,如图所示,则阴极的电极反应为:___________ 。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为 ___________ L。

(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:
(2)SO2可以与H2S反应,请写出其化学方程式:
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解,得到无色溶液 | / |
| II | 取实验I的溶液, | 样品存在氧化变质 | |
| III | 另取实验I的溶液, | 样品并未完全氧化变质 |

您最近一年使用:0次



