1 . 砷(33As)元素可以形成多种化合物,有着广泛的用途。回答下列问题:
(1)As的基态原子的价电子排布式为_______ 。
(2)雌黄和雄黄早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。As元素有+2、+3两种常见价态,在一定条件下,雌黄和雄黄的转化关系如图所示:
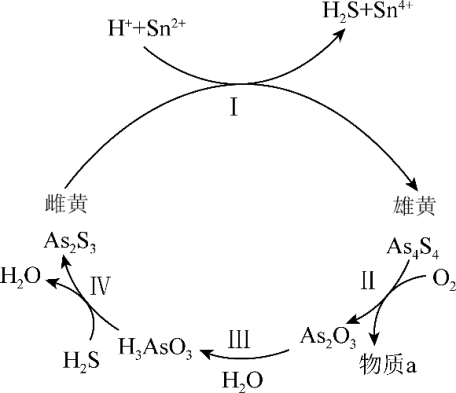
①Ⅰ→Ⅳ中属于氧化还原反应的是_______ 。
②反应Ⅰ中,As2S3和Sn2+恰好完全反应时,其物质的量之比是_______ 。
③反应Ⅱ化学方程式是_______ 。
(3)砷化镓 (GaAs)是一种重要的半导体材料。
①GaAs与GaN都是由原子之间以共价键的成键方式结合而成的晶体。GaAs熔点为1238℃,GaN熔点为1500℃,GaAs熔点低于GaN的原因为_______ 。
②砷化镓晶胞结构如下图所示。平均每个晶胞所含Ga的原子个数为_______ 。
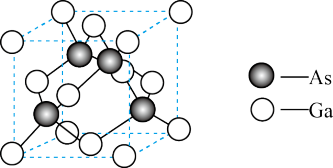
③晶体密度ρ可以用晶胞的质量除以体积来求算。已知GaAs晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA,则该晶体的密度ρ=_______ g∙cm-3(列出计算式即可,GaAs的摩尔质量为145g∙mol-1)。
(1)As的基态原子的价电子排布式为
(2)雌黄和雄黄早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。As元素有+2、+3两种常见价态,在一定条件下,雌黄和雄黄的转化关系如图所示:

①Ⅰ→Ⅳ中属于氧化还原反应的是
②反应Ⅰ中,As2S3和Sn2+恰好完全反应时,其物质的量之比是
③反应Ⅱ化学方程式是
(3)砷化镓 (GaAs)是一种重要的半导体材料。
①GaAs与GaN都是由原子之间以共价键的成键方式结合而成的晶体。GaAs熔点为1238℃,GaN熔点为1500℃,GaAs熔点低于GaN的原因为
②砷化镓晶胞结构如下图所示。平均每个晶胞所含Ga的原子个数为

③晶体密度ρ可以用晶胞的质量除以体积来求算。已知GaAs晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA,则该晶体的密度ρ=
您最近一年使用:0次
2022-09-01更新
|
147次组卷
|
2卷引用:北京市房山区2021-2022学年高三上学期期末考试化学试题
2 . 某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成。五种元素分处三个短周期,且包含地壳中含量前三的三种元素。五种元素原子的最外层电子数之和为20。下列说法正确的是
| A.简单离子半径:Z>X>W |
| B.最简单氢化物的稳定性:W>Y>Z |
| C.W分别与R、Z形成的三原子分子均为V形分子 |
| D.常见单质的熔点:X>Y>Z>W>R |
您最近一年使用:0次
3 . 回答下列问题
(1)第三周期元素氟化物的熔点如下表:
解释表中氟化物熔点变化的原因:_______ 。
(2) 、
、 都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示:
都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示:
解释 、
、 熔点变化的原因:
熔点变化的原因:_______ 。
(3)正戊烷、异戊烷、正丁烷、异丁烷的熔点由低到高的顺序为_______ 。
(4)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为_______ 晶体。
(1)第三周期元素氟化物的熔点如下表:
| 化合物 |  |  |  |  |  |  |
| 熔点/℃ | 993 | 1261 | 1291 | 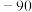 | 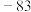 | 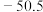 |
(2)
 、
、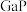 都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示:
都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示:| 物质 |  | 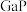 |
| 熔点/℃ | 1700 | 1480 |
 、
、 熔点变化的原因:
熔点变化的原因:(3)正戊烷、异戊烷、正丁烷、异丁烷的熔点由低到高的顺序为
(4)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
您最近一年使用:0次
名校
解题方法
4 . 几种物质的沸点如图所示。下列推断正确的是
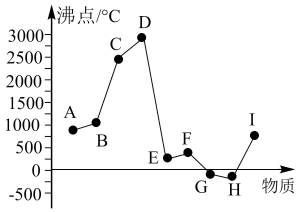
| A.D可能为共价晶体,H为分子晶体 |
| B.G可能为离子晶体,A可能为分子晶体 |
| C.G、H一定是分子晶体,E、F一定是金属晶体 |
| D.D可能为共价晶体,B一定是离子晶体 |
您最近一年使用:0次
2022-08-28更新
|
1502次组卷
|
8卷引用:全书综合评测
5 . 根据下列几种物质的熔点和沸点数据判断,下列有关说法错误的是
注: 熔点在
熔点在 条件下测定。
条件下测定。
| 物质 |  |  | 单质B |
| 熔点/℃ | 190 | 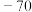 | 2300 |
| 沸点/℃ | 182.7 | 57.6 | 2500 |
 熔点在
熔点在 条件下测定。
条件下测定。A. 是分子晶体 是分子晶体 | B.单质B是共价晶体 |
C. 加热能升华 加热能升华 | D.单质B和 晶体类型相同 晶体类型相同 |
您最近一年使用:0次
2022-08-28更新
|
358次组卷
|
2卷引用:第二节 分子晶体与共价晶体 第2课时 共价晶体
6 . 下列晶体分类中正确的一组是
| 离子晶体 | 共价晶体 | 分子晶体 | |
| A |  | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C |  |  |  |
| D |  | 金刚石 | 玻璃 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-28更新
|
244次组卷
|
2卷引用:第三节 金属晶体与离子晶体 第2课时 离子晶体、过渡晶体与混合型晶体
7 . 某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成,五种元素分处三个短周期,且包含地壳中含量前三的三种元素。五种元素原子的最外层电子数之和为20。下列说法错误的是
| A.简单离子半径:Z>X>W |
| B.最简单氢化物的稳定性:W>Y>Z |
| C.W分别与R、Z形成的三原子分子均为V形分子 |
| D.常见单质的熔点:Y>X>Z>W>R |
您最近一年使用:0次
解题方法
8 . 下表是某些共价晶体的熔点和硬度。
分析表中的数据,判断下列叙述正确的是
| 共价晶体 | 金刚石 | 氮化硼 | 碳化硅 | 石英 | 硅 | 锗 |
熔点/ | 3900 | 3000 | 2600 | 1710 | 1415 | 1211 |
| 硬度 | 10 | 9.5 | 9.5 | 7.0 | 6.5 | 6.0 |
| A.构成共价晶体的原子种类越多,晶体的熔点越高 |
| B.一般构成共价晶体的原子间的共价键键能越大,晶体的熔点越高 |
| C.构成共价晶体的原子的半径越大,晶体的硬度越大 |
| D.构成共价晶体的原子的相对原子质量越大,晶体的硬度越大 |
您最近一年使用:0次
2022-08-22更新
|
178次组卷
|
2卷引用:专题3 微粒间作用力与物质性质 第三单元 共价键共价晶体 第2课时 共价键的键能与化学反应的反应热 共价晶体
名校
9 . 下列说法中,正确的是
| A.同类型原子晶体中,共价键的键长越短,键能越大,熔点就越高 |
| B.金属晶体的熔、沸点一定比分子晶体的高 |
| C.分子内共价键越强,分子热稳定性越强,其晶体熔沸点越高 |
| D.离子晶体离子键越强,熔沸点越高,导电能力越强 |
您最近一年使用:0次
10 . 共价晶体
| 概念 | 共价晶体是原子之间以 | |
| 构成粒子 | ||
| 微粒间的作用 | ||
| 物理性质 | 熔、沸点 | |
| 常见共价晶体 | 金刚石、单晶硅、碳化硅(SiC)、二氧化硅(SiO2)等。 | |
| 典型共价晶体 | 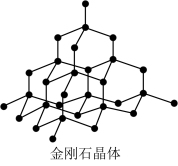 每个C原子形成4个C-C键,构成正四面体形成空间网状结构,其中n(C):n(C-C)=1:2 | 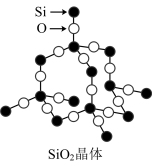 每个Si形成4个Si-O键,每个O形成2个O-Si键,向空间伸展形成网状结构,不存在单个分子,Si与O个数比为1:2,SiO2为化学式 |
您最近一年使用:0次



