名校
解题方法
1 . 碳化硅的一种晶体(SiC)具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列三种晶体:①金刚石②晶体硅③碳化硅中,它们的熔点由高到低的顺序是
| A.①③② | B.②③① | C.③①② | D.②①③ |
您最近半年使用:0次
2024-04-02更新
|
188次组卷
|
16卷引用:宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题
宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题云南省蒙自一中2021-2022学年高二下学期3月份考试化学试题福建省莆田第十五中学2021-2022学年高二下学期期中考试化学试题(已下线)2011-2012学年甘肃省甘谷一中高二下学期第二次月考化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷2014-2015福建省漳浦县三校高二下学期期中化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:3.2 分子晶体与原子晶体(第2课时)贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题福建省莆田第二十五中学2019-2020学年高二下学期返校考试化学试题江苏省泗阳县众兴中学2020-2021学年高二上学期10月月考化学试题江苏省泗阳县实验高级中学2021-2022学年高二上学期第一次质量调研化学试题(已下线)第三章章节专项提升河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷(已下线)3.2.2 共价晶体课堂例题
2 . 科学家利用原子序数依次递增的四种短周期元素W、X、Y和Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图所示。(注:实线代表共价键,Y与Y之间的其他重复单元的W、X未标注),已知W、X,Z分别位于不同周期,Z的原子半径在同周期元素中最大。下列判断正确的是
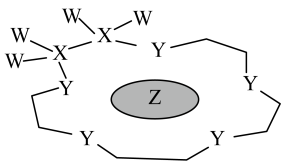

A.Y、Z简单离子半径的大小: |
| B.X、Y简单气态氧化物的稳定性:X>Y |
| C.Y与Z形成的化合物中化学键类型相同 |
| D.X元素和Z元素分别形成的单质的熔点可能是X>Z |
您最近半年使用:0次
名校
解题方法
3 . SiH4与NH3制备氮化硅(熔点1900℃)的反应为 ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是| A.熔点:单晶硅>氮化硅 | B.未成对电子数:Si<N |
| C.键角:SiH4>NH3 | D.NH3是由极性键构成的三角锥形分子 |
您最近半年使用:0次
2023·辽宁·一模
4 . 工业上制备粗硅的反应为 ,若C过量,还会生成SiC.下列叙述错误的是
,若C过量,还会生成SiC.下列叙述错误的是
 ,若C过量,还会生成SiC.下列叙述错误的是
,若C过量,还会生成SiC.下列叙述错误的是A.1个CO分子内只含有1个 键和2个 键和2个 键 键 |
| B.键能:C—H>Si—H,因此甲硅烷没有甲烷稳定 |
| C.键长:C—Si<Si—Si,因此熔点:SiC>Si |
| D.键长:C一C<Si—Si,因此C的还原性大于Si的还原性 |
您最近半年使用:0次
名校
5 . 下列有关比较正确的是
A.熔点: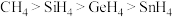 | B.熔、沸点:NaBr>NaCl>MgO |
C.酸性: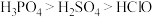 | D.热稳定性: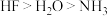 |
您最近半年使用:0次
2023-01-11更新
|
346次组卷
|
2卷引用:浙江省杭州市学军中学2022-2023学年高二上学期期末考试化学试题
6 . 下列有关生活中的化学知识不正确的是
| A.硫酸铜可用于游泳池消毒,也可用于配制农业杀菌剂 |
| B.铁制品通过发蓝处理,在其表面产生致密的氧化物保护薄膜 |
| C.乙二醇水溶液凝固点很高,可作汽车发动机的抗冻剂 |
| D.碳化硅俗称金刚砂,硬度很大,可用作砂纸和砂轮的磨料 |
您最近半年使用:0次
7 .  作为第二代半导体材料的代表,具有宽禁带、高频、高压、抗辐射、耐高温及发光效率高的特点,被广泛应用于移动通信、无线通信、光纤通信、LED、卫星导航等领域。
作为第二代半导体材料的代表,具有宽禁带、高频、高压、抗辐射、耐高温及发光效率高的特点,被广泛应用于移动通信、无线通信、光纤通信、LED、卫星导航等领域。 晶胞结构如图所示,晶胞边长为apm,下列说法正确的是
晶胞结构如图所示,晶胞边长为apm,下列说法正确的是
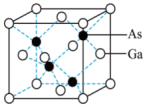
 作为第二代半导体材料的代表,具有宽禁带、高频、高压、抗辐射、耐高温及发光效率高的特点,被广泛应用于移动通信、无线通信、光纤通信、LED、卫星导航等领域。
作为第二代半导体材料的代表,具有宽禁带、高频、高压、抗辐射、耐高温及发光效率高的特点,被广泛应用于移动通信、无线通信、光纤通信、LED、卫星导航等领域。 晶胞结构如图所示,晶胞边长为apm,下列说法正确的是
晶胞结构如图所示,晶胞边长为apm,下列说法正确的是
A.基态砷原子价电子排布图为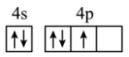 |
B. 属于分子晶体 属于分子晶体 |
C. 的配位数为8 的配位数为8 |
D.该晶体密度为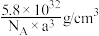 |
您最近半年使用:0次
2022-12-16更新
|
658次组卷
|
3卷引用: 重庆市2023届高三第一次学业资料评价(12月T8联考)化学试题
重庆市2023届高三第一次学业资料评价(12月T8联考)化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)黑龙江省富锦市第一中学2022-2023学年高二上学期期末考试化学试题
21-22高二下·全国·单元测试
解题方法
8 . 共价晶体的结构特点及物理性质
(1)概念:相邻原子间以_____________ 相结合形成共价键三维骨架结构的晶体。
(2)构成微粒及微粒间作用

(3)物理性质
①共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点_____________ ,硬度_____________ ,_____________ 溶于常见溶剂,一般_____________ 导电。
②结构相似的共价晶体,原子半径越_____________ ,键长_____________ ,键能越_____________ ,晶体的熔点越高。
(1)概念:相邻原子间以
(2)构成微粒及微粒间作用

(3)物理性质
①共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点
②结构相似的共价晶体,原子半径越
您最近半年使用:0次
9 . 下列陈述Ⅰ和陈述Ⅱ均正确且有因果关系的是
| 选项 | 选项I | 选项II |
| A | Si-O键键能比Si-H键高 |  的熔沸点比 的熔沸点比 高 高 |
| B | Cl的非金属性比Si强 |  溶液中滴加盐酸产生白色凝胶 溶液中滴加盐酸产生白色凝胶 |
| C | 生铁中含有碳元素而纯铁中不含 | 生铁比纯铁熔点更低,硬度更大 |
| D | 增大压强, 平衡正移 平衡正移 | 压缩 和 和 混合气体体积,红棕色变深 混合气体体积,红棕色变深 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . 重铬酸钾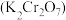 在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为  ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
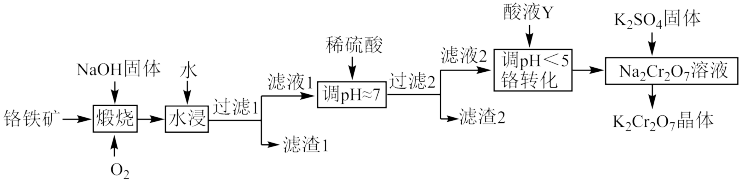
回答下列问题:
(1)基态氧原子的未成对电子数为_______ ;二氧化硅比二氧化碳熔点高得多的最主要原因是_______ 。
(2)煅烧铬铁矿后生成 和
和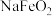 等,已知
等,已知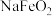 遇水会较强烈水解生成红褐色沉淀,
遇水会较强烈水解生成红褐色沉淀,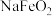 水解的离子方程式是
水解的离子方程式是_______ ;滤液1中的阴离子主要有 、
、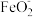 、
、_______ 。
(3)流程中若省去 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是_______ 。
(4)请写出离子方程式并从化学平衡的角度分析加入酸液Y的作用:_______ 。
(5)由于 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠
酸性废水需要进行处理,可用焦亚硫酸钠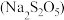 将
将 转化为毒性较低的
转化为毒性较低的  ,室温下再调节溶液pH,生成
,室温下再调节溶液pH,生成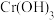 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于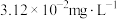 。室温下
。室温下 ,则:
,则:
① 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
②溶液pH至少要大于_______ 。
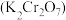 在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为  ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
回答下列问题:
(1)基态氧原子的未成对电子数为
(2)煅烧铬铁矿后生成
 和
和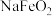 等,已知
等,已知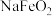 遇水会较强烈水解生成红褐色沉淀,
遇水会较强烈水解生成红褐色沉淀,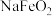 水解的离子方程式是
水解的离子方程式是 、
、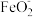 、
、(3)流程中若省去
 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是(4)请写出离子方程式并从化学平衡的角度分析加入酸液Y的作用:
(5)由于
 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠
酸性废水需要进行处理,可用焦亚硫酸钠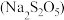 将
将 转化为毒性较低的
转化为毒性较低的  ,室温下再调节溶液pH,生成
,室温下再调节溶液pH,生成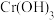 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于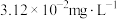 。室温下
。室温下 ,则:
,则:①
 参加反应的离子方程式为
参加反应的离子方程式为②溶液pH至少要大于
您最近半年使用:0次



