名校
1 . 下列说法不正确 的是
| A.常温下,测定0.1mol·L-1醋酸溶液的pH可证明醋酸是弱电解质 |
| B.等体积pH=2的两种酸分别与足量的铁反应,单位时间内酸性较强的酸与铁反应速率更快 |
| C.由反应NaR+CO2(少量)+H2O=HR+NaHCO3可知:Ka1(H2CO3)>Ka(HR)>Ka2(H2CO3) |
| D.相同温度下,与相同浓度、相同体积的盐酸和醋酸溶液恰好中和时消耗NaOH的物质的量相同 |
您最近一年使用:0次
2022-04-04更新
|
407次组卷
|
5卷引用:福建省三明第一中学2022-2023学年高二上学期中考试化学试题
名校
2 . 甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同、质量、大小相等的锌粒放入两支试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按下图装好,观察现象。
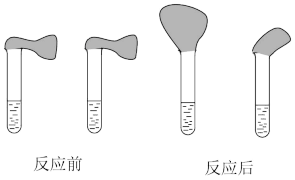
乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为0.05mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH___________ 1(填“>”“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是___________ 。
A. 装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件,弱电解质平衡发生移动。加水稀释,弱酸HA的电离程度___________ (填“增大、减小、不变”)。
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L -1的HA溶液中,选择加入___________试剂。
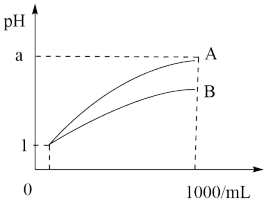
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有___________。
甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同、质量、大小相等的锌粒放入两支试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按下图装好,观察现象。

乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为0.05mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH
A. 装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件,弱电解质平衡发生移动。加水稀释,弱酸HA的电离程度
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L -1的HA溶液中,选择加入___________试剂。
| A.NaA固体(可完全溶于水) | B.1mol·L-1 NaOH溶液 |
| C.1mol·L-1 H2SO4 | D.2mol·L-1 HA |

| A.若a=4,则A是强酸,B是弱酸 |
| B.若1<a<4,则A、B都是弱酸 |
| C.两种酸溶液的物质的量浓度一定相等 |
| D.稀释后,A溶液的酸性比B溶液弱 |
您最近一年使用:0次
3 . 下列有关电解质溶液的说法正确的是
A.用 溶液做导电实验,灯泡很暗,证明 溶液做导电实验,灯泡很暗,证明 是弱电解质 是弱电解质 |
B. 相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的 相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的 仍然相同,则 仍然相同,则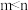 |
C.常温下,在 的 的 溶液中加入少量 溶液中加入少量 晶体,能使溶液的 晶体,能使溶液的 减小且 减小且 的值增大 的值增大 |
D.常温下, 的 的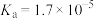 , , 的 的 , , 溶液中的 溶液中的 与 与 溶液中的 溶液中的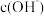 相等 相等 |
您最近一年使用:0次
2021-08-07更新
|
831次组卷
|
9卷引用:2016-2017学年浙江省嘉兴一中高二上期中化学试卷
2016-2017学年浙江省嘉兴一中高二上期中化学试卷浙江省宁波市余姚中学2017-2018学年高二上学期期中考试化学试题2016-2017学年安徽省六安一中高二上阶段测二化学卷福建省三明市第一中学2017-2018学年高二上学期第二次月考化学试题四川省宜宾市第四中学2018-2019学年高二上学期12月月考化学试题云南省玉溪市景东一中2018-2019学年高二6月份考试化学试题选择性必修1 专题3 第一单元 弱电解质的电离平衡(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)3.1.1强电解质和弱电解质 弱电解质的电离平衡 课后
名校
4 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用pH计测定相同浓度的 溶液和NaClO溶液的pH,前者的pH小于后者的 溶液和NaClO溶液的pH,前者的pH小于后者的 | HClO的酸性弱于 |
| B | 向较浓的 溶液中滴入少量酸性 溶液中滴入少量酸性 溶液,观察 溶液,观察 溶液紫色是否褪去 溶液紫色是否褪去 | 证明 有还原性 有还原性 |
| C | 常温下测得0.1mol/L 溶液和0.1mol/L 溶液和0.1mol/L 溶液的pH分别为0.7和1.0 溶液的pH分别为0.7和1.0 | 硫元素的非金属性强于氮元素 |
| D | 向2mL1mol/LNaOH溶液中加1mL0.1mol/L 溶液,产生白色沉淀;再加入1mL0.1mol/L 溶液,产生白色沉淀;再加入1mL0.1mol/L 溶液,产生红褐色沉淀。 溶液,产生红褐色沉淀。 | 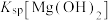 大于 大于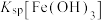 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-17更新
|
777次组卷
|
6卷引用:黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期11月期中化学试题
5 . 用下列实验装置进行相应实验,实验设计评价不正确的是
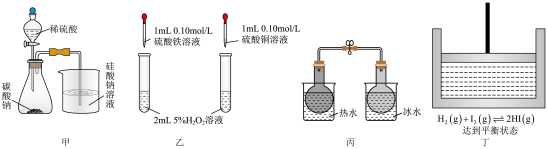

| A.利用装置甲可验证电离常数Ka1(H2CO3)> Ka1(H2SiO3) |
| B.利用装置乙证明对H2O2分解反应催化效果Fe3+优于Cu2+ |
C.利用装置丙可探究温度对平衡2NO2(g) N2O4(g)的影响 N2O4(g)的影响 |
D.利用装置丁不能探究压强对平衡H2(g)+I2(g) 2HI(g)的影响 2HI(g)的影响 |
您最近一年使用:0次
2023-12-03更新
|
159次组卷
|
2卷引用:山东省菏泽市2023-2024学年高二上学期11月期中化学试题
6 . 25℃时部分弱电解质的电离常数如下表:
(1)①25℃时,pH相等的HCN、 、
、 物质的量浓度从大到小的顺序是
物质的量浓度从大到小的顺序是_______ 。
②下列反应方程式正确的是_______ 。
A.少量的 通入到NaClO溶液中:
通入到NaClO溶液中: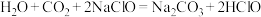
B.往 溶液中滴加少量
溶液中滴加少量 :
:
C.往 溶液中滴加过量HCN:
溶液中滴加过量HCN: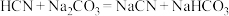
D.往 溶液中滴加HClO:
溶液中滴加HClO:
(2)25℃时,氨水与 的混合溶液
的混合溶液 ,该溶液中
,该溶液中 :
:
___________ 。
(3)请设计实验证明, 溶液中存在
溶液中存在 的电离平衡:
的电离平衡:_______ 。
| 物质 | HCN |  | HClO |  |  |
| 电离常数 | 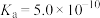 | 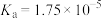 | 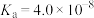 |   |  |
 、
、 物质的量浓度从大到小的顺序是
物质的量浓度从大到小的顺序是②下列反应方程式正确的是
A.少量的
 通入到NaClO溶液中:
通入到NaClO溶液中: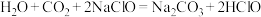
B.往
 溶液中滴加少量
溶液中滴加少量 :
:
C.往
 溶液中滴加过量HCN:
溶液中滴加过量HCN: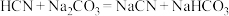
D.往
 溶液中滴加HClO:
溶液中滴加HClO:
(2)25℃时,氨水与
 的混合溶液
的混合溶液 ,该溶液中
,该溶液中 :
:
(3)请设计实验证明,
 溶液中存在
溶液中存在 的电离平衡:
的电离平衡:
您最近一年使用:0次
名校
7 . 下列事实中能证明 是弱电解质的有几项
是弱电解质的有几项
①氨水能与 溶液反应:
溶液反应:
② 的氨水与
的氨水与 的盐酸恰好完全反应
的盐酸恰好完全反应
③常温下, 的浓氨水中加水至
的浓氨水中加水至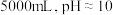
④用氨水做导电实验,灯泡很暗
⑤氯化铵溶液与 溶液反应:
溶液反应: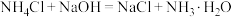
⑥常温下, 的氨水中
的氨水中
 是弱电解质的有几项
是弱电解质的有几项①氨水能与
 溶液反应:
溶液反应:
②
 的氨水与
的氨水与 的盐酸恰好完全反应
的盐酸恰好完全反应③常温下,
 的浓氨水中加水至
的浓氨水中加水至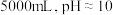
④用氨水做导电实验,灯泡很暗
⑤氯化铵溶液与
 溶液反应:
溶液反应: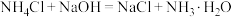
⑥常温下,
 的氨水中
的氨水中
| A.4项 | B.3项 | C.2项 | D.1项 |
您最近一年使用:0次
8 . Ⅰ.25℃时, 、
、 、
、 三种酸分两步电离,它们的电离平衡常数如表。
三种酸分两步电离,它们的电离平衡常数如表。
(1) 是
是_______ 元酸。
(2)在相同条件下,试比较 、
、 和
和 的酸性从强到弱顺序为
的酸性从强到弱顺序为_______ 。
(3)向 溶液中加入足量
溶液中加入足量 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
Ⅱ.甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如图:

甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入 的HA、
的HA、 溶液各
溶液各 ,按图装好,观察现象。
,按图装好,观察现象。
乙:测定物质的量浓度均为 和
和 溶液的氢离子浓度。
溶液的氢离子浓度。
(4)甲方案中,说明HA是弱电解质的实验现象是_______ ;乙方案中说明HA是弱电解质的理由是:_______ 。
(5)甲同学为了进一步证明弱电解质电离平衡移动的情况,用浓度均为 的HA和
的HA和 溶液,按表中数据配制总体积相同的系列溶液(混合后体积变化忽略不计),测定氢离子浓度,记录数据。
溶液,按表中数据配制总体积相同的系列溶液(混合后体积变化忽略不计),测定氢离子浓度,记录数据。
①由实验Ⅰ和Ⅱ可知,稀释HA溶液,电离平衡_______ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:_______ 。
②由实验Ⅱ~Ⅷ可知,增大 浓度,HA电离平衡逆向移动。
浓度,HA电离平衡逆向移动。
(6)乙同学查资料得室温下HA的电离平衡常数 ,则
,则 溶液中,HA的电离度为
溶液中,HA的电离度为_______ 。
 、
、 、
、 三种酸分两步电离,它们的电离平衡常数如表。
三种酸分两步电离,它们的电离平衡常数如表。 |  | |
 | 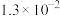 | 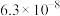 |
 | 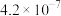 | 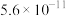 |
 |  |  |
 是
是(2)在相同条件下,试比较
 、
、 和
和 的酸性从强到弱顺序为
的酸性从强到弱顺序为(3)向
 溶液中加入足量
溶液中加入足量 溶液,反应的离子方程式为
溶液,反应的离子方程式为Ⅱ.甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如图:

甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入
 的HA、
的HA、 溶液各
溶液各 ,按图装好,观察现象。
,按图装好,观察现象。乙:测定物质的量浓度均为
 和
和 溶液的氢离子浓度。
溶液的氢离子浓度。(4)甲方案中,说明HA是弱电解质的实验现象是
(5)甲同学为了进一步证明弱电解质电离平衡移动的情况,用浓度均为
 的HA和
的HA和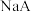 溶液,按表中数据配制总体积相同的系列溶液(混合后体积变化忽略不计),测定氢离子浓度,记录数据。
溶液,按表中数据配制总体积相同的系列溶液(混合后体积变化忽略不计),测定氢离子浓度,记录数据。| 序号 |  |  | 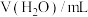 |  |  |
| Ⅰ | 40.00 | / | / | 0 |  |
| Ⅱ | 4.00 | / | 36.00 | 0 |  |
| … | |||||
| Ⅶ | 4.00 | 3.00 | 33.00 | 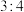 |  |
| Ⅷ | 4.00 | 4.00 | 32.00 |  |  |
②由实验Ⅱ~Ⅷ可知,增大
 浓度,HA电离平衡逆向移动。
浓度,HA电离平衡逆向移动。(6)乙同学查资料得室温下HA的电离平衡常数
 ,则
,则 溶液中,HA的电离度为
溶液中,HA的电离度为
您最近一年使用:0次
22-23高二下·安徽·期中
解题方法
9 . 根据下列图示所得出的结论正确的是


| A.由图甲可知,该反应反应物所含化学键的键能总和大于生成物所含化学键的键能总和 |
B.由图乙能制备 并能较长时间观察其颜色 并能较长时间观察其颜色 |
| C.由图丙可验证Zn与盐酸反应有电子转移 |
D.由图丁可证明: |
您最近一年使用:0次
名校
10 . 根据下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某钠盐粉末上滴加浓盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐一定为 |
| B | 先将注射器充满 气体,然后将活塞往里推 气体,然后将活塞往里推 | 注射器内气体颜色加深 | 证明加压平衡向生成 气体的方向移动 气体的方向移动 |
| C | pH试纸测0.1 mol·L  溶液 溶液 | pH约为5 | 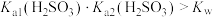 |
| D | 向 溶液中滴加过量氨水 溶液中滴加过量氨水 | 得到澄清溶液 |  与 与 能大量共存 能大量共存 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-30更新
|
146次组卷
|
3卷引用: 福建省福州第三中学2022-2023学年高二下学期期中考试化学试题



