甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同、质量、大小相等的锌粒放入两支试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按下图装好,观察现象。
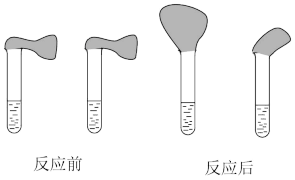
乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为0.05mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH___________ 1(填“>”“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是___________ 。
A. 装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件,弱电解质平衡发生移动。加水稀释,弱酸HA的电离程度___________ (填“增大、减小、不变”)。
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L -1的HA溶液中,选择加入___________试剂。
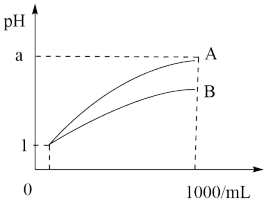
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有___________。
甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同、质量、大小相等的锌粒放入两支试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按下图装好,观察现象。

乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为0.05mL)分别稀释至100mL,再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH
A. 装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件,弱电解质平衡发生移动。加水稀释,弱酸HA的电离程度
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L -1的HA溶液中,选择加入___________试剂。
| A.NaA固体(可完全溶于水) | B.1mol·L-1 NaOH溶液 |
| C.1mol·L-1 H2SO4 | D.2mol·L-1 HA |

| A.若a=4,则A是强酸,B是弱酸 |
| B.若1<a<4,则A、B都是弱酸 |
| C.两种酸溶液的物质的量浓度一定相等 |
| D.稀释后,A溶液的酸性比B溶液弱 |
更新时间:2021-12-29 00:22:45
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________________ 。
(2)常温下0.1 mol·L-1的CH3COOH溶液,若升高温度,上述4种表达式的数据增大的是______ 。
A.c(H+) B.c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D.c(CH3COO-)·c(H+)/c(CH3COOH)
(3)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
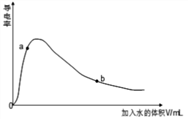
n(H+)∶a_____ b;c(CH3COO-)∶a_____ b;完全中和时消耗NaOH的物质的量∶a_____ b;
(4)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是__________ (填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)常温下0.1 mol·L-1的CH3COOH溶液,若升高温度,上述4种表达式的数据增大的是
A.c(H+) B.c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D.c(CH3COO-)·c(H+)/c(CH3COOH)
(3)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):

n(H+)∶a
(4)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】比较填空(填“>”、“<”或“=”)
(1)Ⅰ.比较等体积等浓度的溶液①盐酸 ②醋酸 与足量锌粒反应产生氢气的体积,①________ ②
Ⅱ.比较2H2(g)+O2(g) =2H2O(g) ΔH 1 2H2(g)+O2(g)=2H2O(l) ΔH2的反应热 ΔH1_______ ΔH2
Ⅲ.比较常温下两溶液水的电离程度,①pH=4盐酸 ②pH =10氨水溶液①________ ②
Ⅳ.同温度下溶液①使甲基橙呈现红色,溶液②使石蕊呈现紫色,比较两者pH①__________ ②
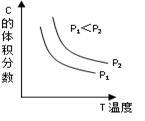
(2)Ⅴ.已知某可逆反应aA(g) + bB(g) cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b ___________ c + d
Ⅵ.比较①0.1mol/L醋酸与②0.01mol/L醋酸的导电能力,①________ ②
Ⅶ.1mol/L氨水与0.1mol/L氨水的c(OH-)之比_______ 10
Ⅷ.体积相同的恒容密闭容器,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,相同条件下发生反应2SO2+O2 2SO3平衡时 SO2的转化率A
2SO3平衡时 SO2的转化率A_______ B
(1)Ⅰ.比较等体积等浓度的溶液①盐酸 ②醋酸 与足量锌粒反应产生氢气的体积,①
Ⅱ.比较2H2(g)+O2(g) =2H2O(g) ΔH 1 2H2(g)+O2(g)=2H2O(l) ΔH2的反应热 ΔH1
Ⅲ.比较常温下两溶液水的电离程度,①pH=4盐酸 ②pH =10氨水溶液①
Ⅳ.同温度下溶液①使甲基橙呈现红色,溶液②使石蕊呈现紫色,比较两者pH①
(2)Ⅴ.已知某可逆反应aA(g) + bB(g)
 cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b 
Ⅵ.比较①0.1mol/L醋酸与②0.01mol/L醋酸的导电能力,①
Ⅶ.1mol/L氨水与0.1mol/L氨水的c(OH-)之比
Ⅷ.体积相同的恒容密闭容器,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,相同条件下发生反应2SO2+O2
 2SO3平衡时 SO2的转化率A
2SO3平衡时 SO2的转化率A
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某同学用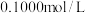 的
的 溶液滴定待测盐酸的浓度。
溶液滴定待测盐酸的浓度。
(1)选用图中仪器__________ (填“A”或“B”)取待测盐酸 于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要
于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要__________ 。

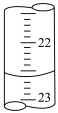
(2)如图是某次滴定时的滴定管中的液面,其读数为__________ mL。
(3)①达到滴定终点的标志是__________ 。
②若出现下列情况,测定结果偏高的是__________ (填字母)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定结束后,俯视液面读数
c.滴定过程中不慎将数滴 溶液滴在锥形瓶外
溶液滴在锥形瓶外
d.碱式滴定管在滴定前有气泡,滴定后气泡消失
(4)常温下,若用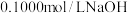 溶液分别滴定
溶液分别滴定 等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
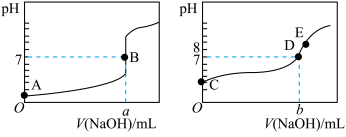
请回答:达到B、D状态时,反应消耗的 溶液的体积a
溶液的体积a______ b(填“>”“<”或“=”)。
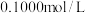 的
的 溶液滴定待测盐酸的浓度。
溶液滴定待测盐酸的浓度。(1)选用图中仪器
 于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要
于锥形瓶中,滴加2滴酚酞作指示剂,所选仪器在使用前需要
(2)如图是某次滴定时的滴定管中的液面,其读数为

(3)①达到滴定终点的标志是
②若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定结束后,俯视液面读数
c.滴定过程中不慎将数滴
 溶液滴在锥形瓶外
溶液滴在锥形瓶外d.碱式滴定管在滴定前有气泡,滴定后气泡消失
(4)常温下,若用
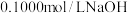 溶液分别滴定
溶液分别滴定 等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
等浓度的盐酸和醋酸溶液,得到两条滴定曲线(已知醋酸钠溶液显碱性),如图所示:
请回答:达到B、D状态时,反应消耗的
 溶液的体积a
溶液的体积a
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】电解质水溶液中存在电离平衡、水解平衡、沉淀溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-) _______ c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②将少量CO2通入NaCN溶液,反应的离子方程式是_______ 。
③25℃时,测得一定浓度 的CH3COONa溶液pH=8,用离子方程式表示溶液呈碱性的原因是_______ ,溶液中 =
=_______ 。
(2)pH=10 氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为_______ 。
(3)已知Ksp(BaCO3)=2.6×10-9 mol/L,现将浓度为2×10-4 mol/L Na2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______ mol/L。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.75×10-6 | Ka=6.2×10-10 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。②将少量CO2通入NaCN溶液,反应的离子方程式是
③25℃时,测得一定浓度 的CH3COONa溶液pH=8,用离子方程式表示溶液呈碱性的原因是
 =
=(2)pH=10 氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为
(3)已知Ksp(BaCO3)=2.6×10-9 mol/L,现将浓度为2×10-4 mol/L Na2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】用实验确定HCOOH是弱电解质。两同学的方案是:
甲:①称取一定质量的HCOOH配制0.1 mol·L-1的溶液100 mL;②用pH试纸测出该溶液的pH,即可证明HCOOH是弱电解质。
乙:①用已知物质的量浓度的HCOOH溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HCOOH是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是____________________ 。
(2)甲方案中,说明HCOOH是弱电解质的理由是测得溶液的pH_______ 1(选填>、<、=)。
乙方案中,说明HCOOH是弱电解质的现象是________
a.装HCl溶液的试管中放出H2的速率快;
b.装HCOOH溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快:
(3)一定温度下有:a.盐酸;b.硫酸;c.醋酸三种酸。
①当其物质的量浓度相同时,c(H+)由大到小的顺序是__________ 。
②当c(H+)相同、体积相同时,同时加入镁,若产生相同体积的H2(相同状况),则开始时的反应速率__________ (用a b c的大小关系表示)。
甲:①称取一定质量的HCOOH配制0.1 mol·L-1的溶液100 mL;②用pH试纸测出该溶液的pH,即可证明HCOOH是弱电解质。
乙:①用已知物质的量浓度的HCOOH溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HCOOH是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HCOOH是弱电解质的理由是测得溶液的pH
乙方案中,说明HCOOH是弱电解质的现象是
a.装HCl溶液的试管中放出H2的速率快;
b.装HCOOH溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快:
(3)一定温度下有:a.盐酸;b.硫酸;c.醋酸三种酸。
①当其物质的量浓度相同时,c(H+)由大到小的顺序是
②当c(H+)相同、体积相同时,同时加入镁,若产生相同体积的H2(相同状况),则开始时的反应速率
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】为确定某酸HA是弱电解质,两同学的实验方案如下:
甲:①称取一定质量的HA,配制0.1 mol·L-1的溶液100 mL;
②用pH计测出该溶液的pH,根据pH=-lg c(H+),推算出溶液中H+的浓度,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制0.1mol·L-1的两种酸溶液各100 mL;
②分别取配制的这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_______ 。
(2)甲方案中说明HA是弱电解质的理由是测得溶液的H+的浓度_______ 0.1 mol·L-1(选填“>”、“<”或“=”)。
(3)乙方案中说明HA是弱电解质的现象是____。
(4)请你评价:乙方案中的不妥之处:__________________________________ 。
(5)已知在T°C时,0.1 mol·L-1HA溶液中HA的电离度为5%,求该温度下HA的电离常数(写出计算过程)_____________________________
甲:①称取一定质量的HA,配制0.1 mol·L-1的溶液100 mL;
②用pH计测出该溶液的pH,根据pH=-lg c(H+),推算出溶液中H+的浓度,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制0.1mol·L-1的两种酸溶液各100 mL;
②分别取配制的这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中说明HA是弱电解质的理由是测得溶液的H+的浓度
(3)乙方案中说明HA是弱电解质的现象是____。
| A.装盐酸的试管中放出气体的速率快; |
| B.装HA溶液的试管中放出气体的速率快; |
| C.两个试管中产生气体的速率一样快。 |
(5)已知在T°C时,0.1 mol·L-1HA溶液中HA的电离度为5%,求该温度下HA的电离常数(写出计算过程)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3(g)+3O2 (g) ΔH=a kJ·mol-1
4NH3(g)+3O2 (g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a______ 0 (填“>”“<”或“=”)
②已知:
N2 (g) + 3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1,
2NH3(g) ΔH=-92.4kJ·mol-1,
2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l) 4NH3(g) + 3O2 (g) ΔH=
4NH3(g) + 3O2 (g) ΔH=____________ ;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是___________ (填字母标号)
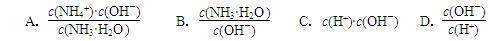
Ⅱ.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.0kJ·mol-1
2SO3(g) ΔH=-196.0kJ·mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是____________ (填字母标号)
②某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是______ ,该温度下的平衡常数K=________ ;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将________ (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将________ 。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l)
 4NH3(g)+3O2 (g) ΔH=a kJ·mol-1
4NH3(g)+3O2 (g) ΔH=a kJ·mol-1进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a
②已知:
N2 (g) + 3H2(g)
 2NH3(g) ΔH=-92.4kJ·mol-1,
2NH3(g) ΔH=-92.4kJ·mol-1,2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l)
 4NH3(g) + 3O2 (g) ΔH=
4NH3(g) + 3O2 (g) ΔH=(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是
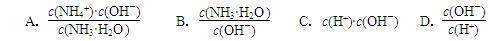
Ⅱ.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g)
 2SO3(g) ΔH=-196.0kJ·mol-1
2SO3(g) ΔH=-196.0kJ·mol-1①容器体积不变时,为了提高SO2的转化率,可采用的措施是
| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
②某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)信息、材料和能源是现代社会发展的三大支柱。发射航天火箭常用氮的氢化物(N2H4)作燃料,N2H4燃烧时用NO2做氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
则N2H4(g)和NO2(g)反应生成氮气和水蒸气的热化学方程式为___ 。当该反应中转移0.8mol电子时,理论上消耗N2H4(g)在标准状况下是___ L。
(2)常温下pH都为2的①CH3COOH ②HCl ③H2SO4三种溶液,其物质的量浓度由大到小的顺序是___ (填序号)。
(3)相同pH的氨水和NaOH溶液加水稀释相同的倍数,pH变化曲线如图所示,则x曲线代表的物质是__ ,当a=9时,稀释后溶液的体积是稀释前溶液体积的__ 倍。

(4)某温度下,纯水中的c(H+)=2×10-7mol/L,则此时c(OH-)=__ 。若温度保持不变,滴入稀硫酸使c(H+)=5×10-6mol/L,则c(OH-)=__ ,由水电离出的c(H+)水=___ 。
(5)100℃时,Kw=10-12,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合液的pH=7,则Ba(OH)2溶液与盐酸的体积比为__ 。
(6)常温下,将100L的盐酸溶液与1L的NaOH溶液混合,充分反应后溶液的pH=7。则混合前盐酸溶液的pH酸与氢氧化钠溶液的pH碱之间应满足的关系是__ 。
已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
则N2H4(g)和NO2(g)反应生成氮气和水蒸气的热化学方程式为
(2)常温下pH都为2的①CH3COOH ②HCl ③H2SO4三种溶液,其物质的量浓度由大到小的顺序是
(3)相同pH的氨水和NaOH溶液加水稀释相同的倍数,pH变化曲线如图所示,则x曲线代表的物质是

(4)某温度下,纯水中的c(H+)=2×10-7mol/L,则此时c(OH-)=
(5)100℃时,Kw=10-12,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
(6)常温下,将100L的盐酸溶液与1L的NaOH溶液混合,充分反应后溶液的pH=7。则混合前盐酸溶液的pH酸与氢氧化钠溶液的pH碱之间应满足的关系是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___ 。用离子方程式表示其原因___ 。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___ 。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___ 。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___ ;正极反应式为___ 。
②反应过程中SO 向
向____ 极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___ 克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1mol•L-1的四种溶液:pH由小到大排列的顺序是__ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___ (填字母)
A.c(H+) B. C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D. E.
E.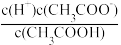
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____ 。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____ (填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____ 。
①向FeCl3溶液中加入少量NaHCO3。产生的现象为
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为
②反应过程中SO
 向
向③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1mol•L-1的四种溶液:pH由小到大排列的顺序是
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.c(H+) B.
 C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D. E.
E.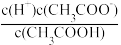
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
⑤标准状况下,将1.12LCO2通入100mL1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
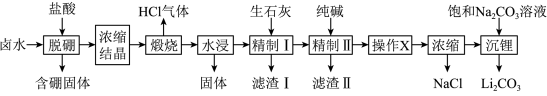
已知:常温下, 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡: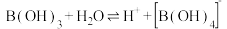 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,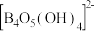 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为___________ ,该溶液pH=___________ 。
(2)滤渣Ⅰ的主要成分是___________ (填化学式);精制Ⅰ后溶液中Li+浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在___________  以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加___________ 的用量(填化学式)。
(3)精制Ⅱ的目的是___________ ;进行操作X时应选择的试剂是___________ 。
 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
已知:常温下,
 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。 
回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡:
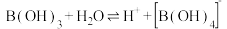 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,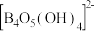 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为(2)滤渣Ⅰ的主要成分是
 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加(3)精制Ⅱ的目的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】水资源的处理和利用是环境化学的重要课题。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是___________ (用离子方程式说明)。几种均为0.1mol L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 ___________ (填罗马数字),判断的理由是 ___________ 。
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为___________ 。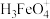 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=___________ 。
(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是
 L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 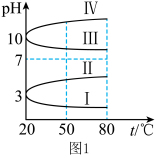
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为

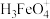 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。
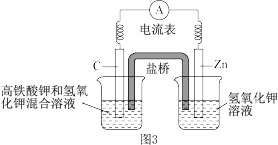

②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硒是一种重要的半导体材料,用富硒铜阳极泥(主要成分为Se、Cu2Se、Ag2Se和银、金等)为原料制备硒的工艺流程如下:
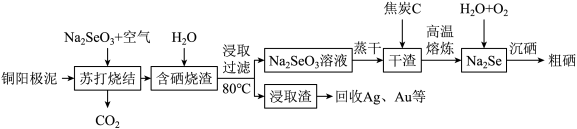
回答下列问题:
(1)试推断34Se在元素周期表中的位置_______ ,据此写出Na2Se的电子式_______ 。
(2)“苏打烧结”时主要发生的化学反应方程式为_______ ; ;
;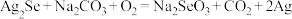 。
。
(3)“含硒烧渣”浸取时需控制温度为80℃,则最佳加热方式为_______ ;浸出渣中主要的杂质有_______ 、Ag、Au等。
(4)已知SeO2易溶于水生成H2SeO3,相同温度下,H2SeO3、H2CO3的电离平衡常数如下:
若向Na2CO3溶液中通入过量SeO2,则下列反应的离子方程式正确的是_______ 。
A.
B.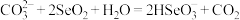
C.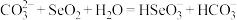
D.
(5)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液可直接制得单质Se,写出电解时的阴极反应式:_______ 。
(6)回收硒还可采用另一工艺:即向阳极泥加入浓硫酸,用水吸收生成的SeO2和SO2,试分析此工艺存在的不足之处_______ (答一点即可)。

回答下列问题:
(1)试推断34Se在元素周期表中的位置
(2)“苏打烧结”时主要发生的化学反应方程式为
 ;
;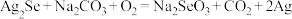 。
。(3)“含硒烧渣”浸取时需控制温度为80℃,则最佳加热方式为
(4)已知SeO2易溶于水生成H2SeO3,相同温度下,H2SeO3、H2CO3的电离平衡常数如下:
| 化学式 | H2SeO3 | H2CO3 |
| 电离平衡常数 | K1=2.7×10-3 K2=2.5×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
A.

B.
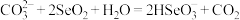
C.
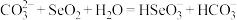
D.

(5)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液可直接制得单质Se,写出电解时的阴极反应式:
(6)回收硒还可采用另一工艺:即向阳极泥加入浓硫酸,用水吸收生成的SeO2和SO2,试分析此工艺存在的不足之处
您最近一年使用:0次



