名校
1 . 下列有关物质的性质和用途具有对应关系的是
A. 能溶于水,可用于工业制盐酸 能溶于水,可用于工业制盐酸 |
B. 不稳定,可用于棉、麻漂白 不稳定,可用于棉、麻漂白 |
C. 有强氧化性,可用于水体杀菌消毒 有强氧化性,可用于水体杀菌消毒 |
D. 溶液呈酸性,可用于蚀刻电路板上的铜 溶液呈酸性,可用于蚀刻电路板上的铜 |
您最近一年使用:0次
2 . 下列有关物质的性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆 |
| B.NaHCO3能与碱反应,可用作焙制糕点的膨松剂 |
| C.浓硫酸具有脱水性,可用于干燥氢气 |
| D.MgO、Al2O3熔点高,可用于制作耐火材料 |
您最近一年使用:0次
2018-03-21更新
|
144次组卷
|
2卷引用:辽宁省丹东市2017-2018学年高一上学期期末质量监测化学试题
名校
解题方法
3 . Ⅰ.元素的“价-类”二维图体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如图所示。回答下列问题:
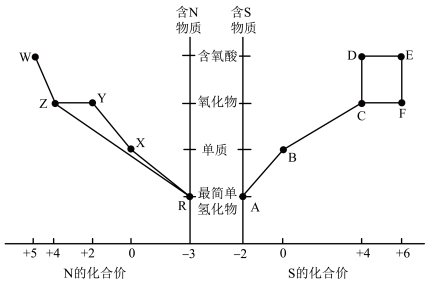
(1)写出检验某溶液中含有铵根离子的实验方法_____ 。
(2)物质R→Y是工业制硝酸的重要反应,其化学方程式是_____ 。
(3)写出在加热条件下物质E的浓溶液与碳单质反应的化学方程式:_____ 。
(4)下列有关图中所示含N、S物质的叙述,正确的是_____(填标号)。
(5)将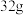 铜与
铜与 一定浓度的物质W充分反应,铜完全溶解,产生标准状况下的物质Y和二氧化氮混合气体共
一定浓度的物质W充分反应,铜完全溶解,产生标准状况下的物质Y和二氧化氮混合气体共 。则混合气体中物质Y的体积为
。则混合气体中物质Y的体积为_____ L(标准状况下)。
(6)在 混合液中,W和E的浓度分别是
混合液中,W和E的浓度分别是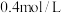 和
和 ,向该混合液中加入
,向该混合液中加入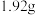 铜粉,加热充分反应后,假设所得溶液体积不变,溶液
铜粉,加热充分反应后,假设所得溶液体积不变,溶液 的物质的量浓度是
的物质的量浓度是_____ 。
Ⅱ.某同学欲选用如图的部分装置和药品探究 的性质。
的性质。
(7) 通入D装置中溶液褪色,体现
通入D装置中溶液褪色,体现 具有
具有_____ 性。
(8)为验证 具有还原性,设计装置的连接顺序为
具有还原性,设计装置的连接顺序为_____ (用字母表示);写出体现该性质的离子反应方程式_____ 。

(1)写出检验某溶液中含有铵根离子的实验方法
(2)物质R→Y是工业制硝酸的重要反应,其化学方程式是
(3)写出在加热条件下物质E的浓溶液与碳单质反应的化学方程式:
(4)下列有关图中所示含N、S物质的叙述,正确的是_____(填标号)。
| A.在催化剂的作用下,R可将Y、Z还原为X |
| B.图中所示的物质中,C与A反应出现淡黄色沉淀,体现C的还原性 |
| C.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生 |
D.Z、C、F均能与 溶液反应,都是酸性氧化物 溶液反应,都是酸性氧化物 |
(5)将
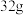 铜与
铜与 一定浓度的物质W充分反应,铜完全溶解,产生标准状况下的物质Y和二氧化氮混合气体共
一定浓度的物质W充分反应,铜完全溶解,产生标准状况下的物质Y和二氧化氮混合气体共 。则混合气体中物质Y的体积为
。则混合气体中物质Y的体积为(6)在
 混合液中,W和E的浓度分别是
混合液中,W和E的浓度分别是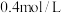 和
和 ,向该混合液中加入
,向该混合液中加入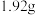 铜粉,加热充分反应后,假设所得溶液体积不变,溶液
铜粉,加热充分反应后,假设所得溶液体积不变,溶液 的物质的量浓度是
的物质的量浓度是Ⅱ.某同学欲选用如图的部分装置和药品探究
 的性质。
的性质。 |  |  |  |  |
| A | B | C | D | E |
(7)
 通入D装置中溶液褪色,体现
通入D装置中溶液褪色,体现 具有
具有(8)为验证
 具有还原性,设计装置的连接顺序为
具有还原性,设计装置的连接顺序为
您最近一年使用:0次
4 . Ⅰ.某同学设计实验探究Cu与98%浓 的反应,装置如图所示,回答下列问题:
的反应,装置如图所示,回答下列问题:
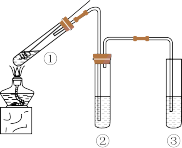
(1)试管①中发生反应的化学方程式为_______ 。
(2)试管②用来检验生成的 ,下列试剂中利用
,下列试剂中利用 的还原性进行检验的是 。
的还原性进行检验的是 。
(3)试管③中盛放______ ,用来吸收 ,防止污染空气。
,防止污染空气。
Ⅱ.如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
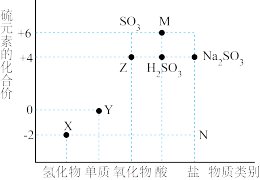
(4)将Z通入紫色石蕊溶液中,实验现象为_______ 。
(5)足量Y与1mol金属铜充分反应,转移电子的物质的量为_______ mol。
(6)将Z通入X的水溶液中,发生反应的化学方程式为_______ 。
(7)碳和M的浓溶液的反应中,氧化剂与还原剂物质的量之比为_______ 。
 的反应,装置如图所示,回答下列问题:
的反应,装置如图所示,回答下列问题:
(1)试管①中发生反应的化学方程式为
(2)试管②用来检验生成的
 ,下列试剂中利用
,下列试剂中利用 的还原性进行检验的是 。
的还原性进行检验的是 。A.酸性 | B.品红溶液 | C.溴水 | D. 溶液 溶液 |
 ,防止污染空气。
,防止污染空气。Ⅱ.如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:

(4)将Z通入紫色石蕊溶液中,实验现象为
(5)足量Y与1mol金属铜充分反应,转移电子的物质的量为
(6)将Z通入X的水溶液中,发生反应的化学方程式为
(7)碳和M的浓溶液的反应中,氧化剂与还原剂物质的量之比为
您最近一年使用:0次
名校
5 . 下列物质的性质与应用对应关系正确的是
| A.二氧化锰具有还原性,可用于实验室制备氯气 |
| B.Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 |
| C.碳酸氢钠能与碱反应,可用作食品的膨松剂 |
| D.氯气具有漂白性,可用于杀菌、消毒 |
您最近一年使用:0次
名校
6 . 化学在生活中有着广泛的应用,下列对应关系错误的是
| 化学性质 | 实际应用 | |
| A | 碳酸氢铵受热易分解 | 焙制糕点 |
| B | 蛋白质受热变性 | 高温杀死流感病毒 |
| C | SO2具有漂白性 | 漂白滋补品银耳等食品 |
| D | Al(OH)3分解吸收大量热量并有水生成 | 阻燃剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大 难挥发性 难挥发性 |
B.在加热条件下铜与浓硫酸反应 强氧化性、酸性 强氧化性、酸性 |
C.蔗糖与浓硫酸反应中有海绵状的炭生成 吸水性 吸水性 |
D.浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色 脱水性 脱水性 |
您最近一年使用:0次
2016-12-09更新
|
750次组卷
|
14卷引用:辽宁省东港市第二中学2023-2024学年高二上学期开学考试化学试题
辽宁省东港市第二中学2023-2024学年高二上学期开学考试化学试题2015-2016学年广西柳州铁路一中高一上期末化学试卷福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高一下学期期末联考化学试题(已下线)2018年12月16日 《每日一题》人教必修1- 每周一测江西省南昌市八一中学、洪都中学、十七中、实验中学四校2018-2019学年高一下学期3月联考化学试题【市级联考】江苏省常州市2018-2019学年高一下学期期中考试化学试题【校级联考】广东省深圳四校发展联盟体2018-2019学年高一第二学期期中考试化学试题(已下线)【南昌新东方】2019 八一、洪都 高一下 第一次月考云南省昆明市东川区明月中学2018-2019学年高一下学期期中考试化学试题苏教版(2020)高一必修第一册专题4第一单元课时2 硫酸鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第2节 硫的转化 课时2 硫酸高一必修第二册(人教2019版)第五章 第一节 硫及其化合物 课时2 硫酸及硫酸根离子的检验第3课时 浓硫酸第2课时 硫酸、硫酸根离子的检验1
名校
8 . A、B、C、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成B的最高价化合物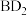 。
。 与
与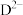 具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸M。G是应用最广泛的金属元素。回答下列问题:
具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸M。G是应用最广泛的金属元素。回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为___________ 。
(2)G在周期表中的位置是___________ 。
(3)B、D、E组成的一种常见盐中,D的质量分数约为 ,该盐溶液与少量M溶液反应的离子方程式为
,该盐溶液与少量M溶液反应的离子方程式为___________ 。
(4)由这些元素组成的物质,其组成和结构信息如下:
①a的化学式为___________ 。
②b的一种常见用途为___________ 。
③已知c中所有原子均满足8电子稳定结构,该化合物的电子式为___________ 。
(5)下列关于元素A、B、D、E、F的说法正确的是___________ 。
a.最高价含氧酸的酸性:
b.离子半径比较:
c.A、B均可与D形成直线形分子
d.可用 试纸测
试纸测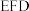 溶液的
溶液的
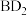 。
。 与
与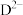 具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸M。G是应用最广泛的金属元素。回答下列问题:
具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸M。G是应用最广泛的金属元素。回答下列问题:(1)
 的离子结构示意图为
的离子结构示意图为(2)G在周期表中的位置是
(3)B、D、E组成的一种常见盐中,D的质量分数约为
 ,该盐溶液与少量M溶液反应的离子方程式为
,该盐溶液与少量M溶液反应的离子方程式为(4)由这些元素组成的物质,其组成和结构信息如下:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含D且含非极性共价键的二元离子化合物,阴阳离子数之比为1∶2 |
| c | 化学式为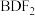 |
②b的一种常见用途为
③已知c中所有原子均满足8电子稳定结构,该化合物的电子式为
(5)下列关于元素A、B、D、E、F的说法正确的是
a.最高价含氧酸的酸性:

b.离子半径比较:

c.A、B均可与D形成直线形分子
d.可用
 试纸测
试纸测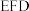 溶液的
溶液的
您最近一年使用:0次
2023-11-15更新
|
154次组卷
|
2卷引用:辽宁省丹东市2023-2024学年高三上学期11月阶段测试化学试题
解题方法
9 . 如图表示的是部分元素在元素周期表中的位置,请按要求回答问题:

(1)⑥元素在周期表中的位置是第_______ 周期第_______ 族,其淡黄色氧化物与 反应的化学方程式是
反应的化学方程式是_______ 。
(2)④元素的一种核素的中子数是10,表示该核素的符号是_______ 。
(3)画出由元素③形成的单质的电子式_______ 。
(4)⑨⑩⑪三种元素的最高价氧化物对应的水化物中,酸性最强的是(填化合物的化学式)____ 。
(5)⑥、⑩两种元素形成的化合物有重要的用途,用电子式表示它的形成过程_______ 。
(6)下列说法正确的是_______(填序号)。

(1)⑥元素在周期表中的位置是第
 反应的化学方程式是
反应的化学方程式是(2)④元素的一种核素的中子数是10,表示该核素的符号是
(3)画出由元素③形成的单质的电子式
(4)⑨⑩⑪三种元素的最高价氧化物对应的水化物中,酸性最强的是(填化合物的化学式)
(5)⑥、⑩两种元素形成的化合物有重要的用途,用电子式表示它的形成过程
(6)下列说法正确的是_______(填序号)。
| A.在元素⑥⑦⑧⑨⑩中,离子半径最小的是⑧ |
| B.⑥元素和④元素形成的化合物中只含有离子键 |
| C.④元素简单氢化物的沸点比⑨元素简单氢化物的沸点高 |
| D.由①④⑩种元素可以组成的酸不止1种 |
您最近一年使用:0次
10 . 氯离子是维持血清电解质平衡和酸碱平衡重要物质,人体中氯的正常值范围是96~106mmol∙L−1,氯及其化合物在生活中也有着重要用途。下图为氯及其化合物的“价—类”二维图。

(1)若经体检测得某人体内 含量为
含量为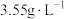 ,此测量值
,此测量值_______ (填“处于”或“不处于”)人体中氯的正常值范围内。
(2)A物质光照分解的产物可以设计成数字化实验。实验步骤如下:
I.将 传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
II.将三种传感器分别插入盛有氯水的广口瓶中;
III.用强光照射氯水,同时开始采集数据。
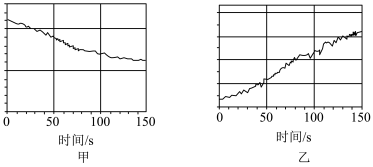
图甲和图乙的纵坐标可能分别为_______ (填序号)。
A.氯水的 、离子浓度 B.氯离子浓度、氯水的
、离子浓度 B.氯离子浓度、氯水的
C.氧气的体积分数、氯离子浓度 D.氧气的体积分数、氯水的
该过程的化学反应方程式为_______ 。
(3)某同学想利用以下试剂探究 的化学性质:
的化学性质:
A. B.
B. C.
C. D.
D.
i.从物质类别的视角, 属于强酸,可能与
属于强酸,可能与_______ 发生反应(填序号)。
ii.从元素价态的视角, 具有氧化性,可能与
具有氧化性,可能与_______ 发生反应(填序号)。
(4)碘是生命体中的必需元素,碘及其化合物在生活中也有重要的用途。实验室制取少量 可用如下方法:
可用如下方法: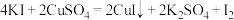 。请根据方程式回答问题:
。请根据方程式回答问题:
①从上述反应中可以判断 和
和 氧化性的关系为
氧化性的关系为_______ >_______ 。
②反应有 生成,转移
生成,转移_______  电子。
电子。

(1)若经体检测得某人体内
 含量为
含量为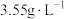 ,此测量值
,此测量值(2)A物质光照分解的产物可以设计成数字化实验。实验步骤如下:
I.将
 传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;II.将三种传感器分别插入盛有氯水的广口瓶中;
III.用强光照射氯水,同时开始采集数据。

图甲和图乙的纵坐标可能分别为
A.氯水的
 、离子浓度 B.氯离子浓度、氯水的
、离子浓度 B.氯离子浓度、氯水的
C.氧气的体积分数、氯离子浓度 D.氧气的体积分数、氯水的

该过程的化学反应方程式为
(3)某同学想利用以下试剂探究
 的化学性质:
的化学性质:A.
 B.
B. C.
C. D.
D.
i.从物质类别的视角,
 属于强酸,可能与
属于强酸,可能与ii.从元素价态的视角,
 具有氧化性,可能与
具有氧化性,可能与(4)碘是生命体中的必需元素,碘及其化合物在生活中也有重要的用途。实验室制取少量
 可用如下方法:
可用如下方法: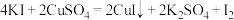 。请根据方程式回答问题:
。请根据方程式回答问题:①从上述反应中可以判断
 和
和 氧化性的关系为
氧化性的关系为②反应有
 生成,转移
生成,转移 电子。
电子。
您最近一年使用:0次



