名校
解题方法
1 .  是人体必需的微量元素。下列关于
是人体必需的微量元素。下列关于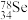 和
和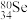 的说法中,正确的是
的说法中,正确的是
 是人体必需的微量元素。下列关于
是人体必需的微量元素。下列关于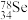 和
和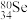 的说法中,正确的是
的说法中,正确的是A.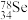 和 和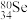 都含有34个中子 都含有34个中子 |
B.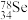 和 和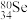 含有不同的电子数 含有不同的电子数 |
C.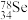 和 和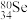 互为同位素 互为同位素 |
D.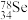 和 和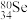 分别含有44个和46个质子 分别含有44个和46个质子 |
您最近一年使用:0次
2024-09-17更新
|
46次组卷
|
10卷引用:专题01 元素周期表【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)
(已下线)专题01 元素周期表【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)江苏省淮安市淮安区2020-2021学年高一上学期期中调研测试化学试题青海省西宁市大通回族土族自治县2022-2023学年高一上学期期末考试化学试题天津市新华中学2022-2023学年高一上学期期末考试化学试题福建省漳州市第一中学2023-2024学年高一上学期化学12月月考(第二单元)福建省福州市四校教学联盟2023-2024学年高一上学期期中质量检测化学试题 青海省西宁市大通县2023-2024学年高一下学期期末联考化学试题吉林省吉林市普通高中2023-2024学年高一上学期期末调研测试化学试题福建省莆田第七中学、第十一中学、第十五中学等校2023-2024学年高一上学期期末联考化学试题北京市中国人民大学附属中学丰台学校2024-2025学年高三上学期 入学测试化学试题
名校
解题方法
2 . 少量铁粉与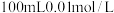 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的
①加 ②加
②加 固体 ③滴入几滴浓盐酸 ④加
固体 ③滴入几滴浓盐酸 ④加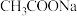 固体 ⑤加
固体 ⑤加 溶液
溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用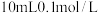 盐酸
盐酸
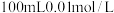 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的①加
 ②加
②加 固体 ③滴入几滴浓盐酸 ④加
固体 ③滴入几滴浓盐酸 ④加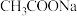 固体 ⑤加
固体 ⑤加 溶液
溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用
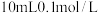 盐酸
盐酸| A.①⑥⑦ | B.③⑤⑧ | C.⑤⑦⑧ | D.③⑦⑧ |
您最近一年使用:0次
2024-09-04更新
|
87次组卷
|
12卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高一下学期期末考试化学试题
黑龙江省哈尔滨市第六中学2020-2021学年高一下学期期末考试化学试题黑龙江省大庆市东风中学2021-2022学年高一下学期期中考试化学试题四川省凉山宁南中学2021-2022学年高二上学期第一次月考化学试题云南省红河哈尼族彝族自治州第一中学2023-2024学年高一下学期5月月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第一次月考化学试题河北省石家庄外国语学校2019-2020学年高二上学期期末考试化学试题四川省简阳市阳安中学2020-2021学年高二上学期9月月考化学试题陕西省渭南市澄城县城关中学2020-2021学年高二上学期第一次月考化学试题宁夏石嘴山市第三中学2020-2021学年高二上学期期中考试化学试题新疆乌鲁木齐市第八中学2020-2021学年高二上学期第一阶段考试化学试题江苏省无锡市太湖高级中学2022-2023学年高二下学期期中考试化学试题(已下线)考点巩固卷09 化学反应速率与化学平衡(一)(7大考向)-2025年高考化学一轮复习考点通关卷(江苏专用)
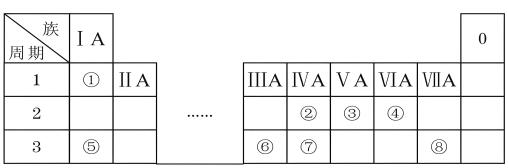
3 . 下表是元素周期表的一部分,表中的每个编号代表一种元素。请根据要求回答问题:___________ ;
(2)⑤⑥⑦对应元素中,金属性最强的元素是___________ (填写元素符号);
(3)元素②与⑦相比,___________ 元素的原子半径较大(填写元素符号);
(4)③和④的气态氢化物的稳定性强弱顺序是:③___________ ④(填“>”或“<”);
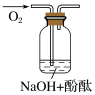
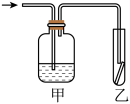
(5)如图,将潮湿的由元素⑧组成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是___________ 。
(2)⑤⑥⑦对应元素中,金属性最强的元素是
(3)元素②与⑦相比,
(4)③和④的气态氢化物的稳定性强弱顺序是:③
(5)如图,将潮湿的由元素⑧组成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是
您最近一年使用:0次
2024-08-31更新
|
10次组卷
|
2卷引用:湖南省张家界市2021-2022学年高一上学期期末考试化学试题
名校
解题方法
4 . 当汽车在行驶过程中发生碰撞事故时,如果达到气囊展开条件,气体发生器接到信号后引燃气体发生剂,产生大量气体,气体发生器的产气药已从叠氮化物型发展到非叠氮化物型,其中以硝基胍(NQ)型和黑索金(RDX)型产气药为主。
(1)硝基胍(CH4N4O2)是白色结晶,密度是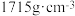 ,微溶于水爆炸时发生反应:
,微溶于水爆炸时发生反应:
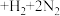 。
。
①硝基胍的摩尔质量为_______ ;52g硝基胍含有氢原子的数目为_______ 电火花点火后冷却到标准状况下,可收集到气体的体积为_______ L。
②0.1mol·L-1硝酸胍溶液是分析化学中的常见试剂,配制250mL该溶液需要硝酸胍的质量为_____ ;若用托盘天平作称量仪器配制时下列部分图示操作正确的_______ 是(填字母)。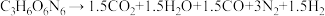 。相同物质的量的硝基胍与黑索金在常压及120℃时产生的气体体积比为
。相同物质的量的硝基胍与黑索金在常压及120℃时产生的气体体积比为_______ 。
(3)叠氮化钠(NaN3)目前汽车安全气囊中的产气药。一种生产工艺流程如下:_______ ;反应中还原剂是_______ ,还原产物是_______ 。
②反应器(Ⅱ)中反应的化学方程式为_______ 。
(1)硝基胍(CH4N4O2)是白色结晶,密度是
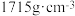 ,微溶于水爆炸时发生反应:
,微溶于水爆炸时发生反应:
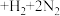 。
。①硝基胍的摩尔质量为
②0.1mol·L-1硝酸胍溶液是分析化学中的常见试剂,配制250mL该溶液需要硝酸胍的质量为

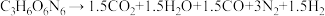 。相同物质的量的硝基胍与黑索金在常压及120℃时产生的气体体积比为
。相同物质的量的硝基胍与黑索金在常压及120℃时产生的气体体积比为(3)叠氮化钠(NaN3)目前汽车安全气囊中的产气药。一种生产工艺流程如下:
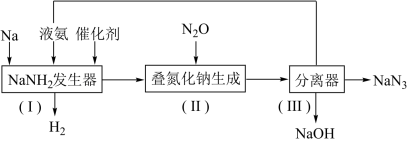
②反应器(Ⅱ)中反应的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。计算:(要求写出简要计算过程)_______ 。
(2)取_______ mL的该硫酸进行稀释后加入足量的Zn就可以制取标准状况下13.44L的H2(结果保留一位小数))。

(2)取
您最近一年使用:0次
名校
解题方法
6 . 某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。_______ 。
(2)加入的试剂④为_______ 。
(3)鉴别溶液D中的金属阳离子时,应加入的试剂依次是_______ ,现象依次是_______ ;请写出鉴别过程中属于氧化还原反应的离子方程式:_______ 。
(4)若取2ml溶液D加入试管中,然后滴加氢氧化钠溶液,产生的现象是_______ ;此现象涉及氧化还原反应的化学方程式是_______ 。
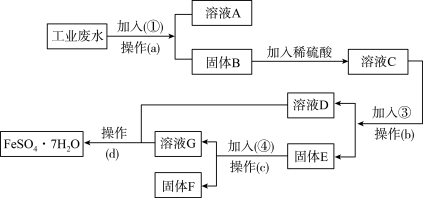
(2)加入的试剂④为
(3)鉴别溶液D中的金属阳离子时,应加入的试剂依次是
(4)若取2ml溶液D加入试管中,然后滴加氢氧化钠溶液,产生的现象是
您最近一年使用:0次
名校
解题方法
7 . 实验室需要用1.0mol/L NaOH溶液480mL进行相关的实验,下列有关配制该溶液的说法不正确的是
| A.用托盘天平称取19.2g NaOH固体 |
| B.将称好的固体倒入烧杯中溶解并用玻璃棒不断搅拌 |
| C.转移溶液时有少量液体溅出则最终溶液的浓度偏低 |
| D.需要的玻璃仪器至少有500mL容量瓶、烧杯、玻璃棒、胶头滴管 |
您最近一年使用:0次
名校
解题方法
8 . 现有下列六种物质:①Al②熔融KHSO4 ③KOH固体④CO2 ⑤盐酸⑥Fe(OH)3胶体⑦碳酸钠粉末⑧蔗糖晶体。请回答下列问题。
(1)上述物质中,属于电解质的是_______ (填写物质的序号,下同),属于非电解质的是_______ 。能导电的是_______ 。
(2)将10.8g的①投入100mL的溶液③中反应的离子方程式为_______ ,若两者恰好完全反应,溶液体积变化忽略不计,则溶液③的物质的量浓度为_______ 。
(3)写出②在该状态下的电离方程式为_______ 。
(4)向⑥Fe(OH)3胶体加入稀H2SO4溶液,产生的现象_______ ;若对实验室制得的⑥Fe(OH)3胶体进行提纯,应该采取的方法是_______ 。
(1)上述物质中,属于电解质的是
(2)将10.8g的①投入100mL的溶液③中反应的离子方程式为
(3)写出②在该状态下的电离方程式为
(4)向⑥Fe(OH)3胶体加入稀H2SO4溶液,产生的现象
您最近一年使用:0次
9 . 某同学通过实验研究 Na2O2与水的反应。
为了探究溶液颜色变化的原因,该同学按照科学的程序,进行了如下实验:
【推理与假设】
(1)Na2O2 与 H2O 反应的化学方程式:_______ 。 向溶液 a 中滴加酚酞本应只会变红,而实验中发现酚酞变红后又褪色。
由此提出如下的假设:
假设 A:_______ 有漂白性;
假设 B:_______ 有漂白性;
假设 C:O2和 NaOH 共同作用有漂白性。
【实验与观察】
(2)请完成下表:
【查阅资料】
该同学查阅资料:H2O2 是一种在碱性条件下不稳定、具有漂白性的物质。
【推理与假设】
该同学认为褪色的原因可能是溶液 a 中存在 H2O2 ,H2O2 漂白了酚酞。
【实验与观察】
(3)实验①取少量溶液 a,加入黑色粉末,快速产生了能使带火星木条复燃的气体O2。
实验②取少量溶液 a 于试管中,加入黑色粉末,充分反应向上层清液中滴入2滴酚酞后变红,10分钟后溶液颜色_______ 。
【实验结论】
实验①证实了Na2O2 与 H2O反应后的溶液 a中存在H2O2;
实验②证实了是H2O2漂白了酚酞。
【交流与评价】
(4)由以上实验结果可知, Na2O2 与 H2O 反应的化学方程式如果分两步书写,可以写成:
第一步:_______ ;
第二步:_______ 。
但课本上没有写出中间产物H2O2,可能的原因是_______ 。
| 操作 | 现象 |
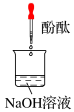
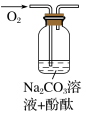
| 向盛有少量 Na2O2 的试管中加入蒸馏水,得到溶液 a | 反应剧烈,产生能使带火星木条复燃的气体 |
| 然后向溶液 a 中滴入两滴酚酞 | 溶液先变红,再逐渐变浅,约 10 分钟溶液变为无色 |
【推理与假设】
(1)Na2O2 与 H2O 反应的化学方程式:
由此提出如下的假设:
假设 A:
假设 B:
假设 C:O2和 NaOH 共同作用有漂白性。
【实验与观察】
(2)请完成下表:
| 实验编号 | 1 | 2 | 3 |
实验装置 |
|
|
|
| 实验假设 | 假设A | 假设B | 假设C |
| 实验现象 | 溶液变红后 10 分钟均无变化 | ||
| 实验结论 | 假设A、B、C | ||
【查阅资料】
该同学查阅资料:H2O2 是一种在碱性条件下不稳定、具有漂白性的物质。
【推理与假设】
该同学认为褪色的原因可能是溶液 a 中存在 H2O2 ,H2O2 漂白了酚酞。
【实验与观察】
(3)实验①取少量溶液 a,加入黑色粉末,快速产生了能使带火星木条复燃的气体O2。
实验②取少量溶液 a 于试管中,加入黑色粉末,充分反应向上层清液中滴入2滴酚酞后变红,10分钟后溶液颜色
【实验结论】
实验①证实了Na2O2 与 H2O反应后的溶液 a中存在H2O2;
实验②证实了是H2O2漂白了酚酞。
【交流与评价】
(4)由以上实验结果可知, Na2O2 与 H2O 反应的化学方程式如果分两步书写,可以写成:
第一步:
第二步:
但课本上没有写出中间产物H2O2,可能的原因是
您最近一年使用:0次
名校
10 . 回答下列问题。
(Ⅰ)新冠肺炎疫情期间,“84消毒液”被广泛应用于物体表面杀菌消毒。高一某学习小组的同学参阅“84消毒液”的配方,欲用NaClO固体配制一定物质的量浓度的NaClO消毒液。
(1)下图是小组在实验室配制该NaClO溶液的过程示意图,其中有错误的是_______ (填操作序号)。_______ mL。
(3)若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______ ;
A.配制前,容量瓶中有少量蒸馏水
B.未冷却,立即转移至容量瓶定容
C.定容时,仰视溶液的凹液面
D.量取浓硫酸时,仰视液体的凹液面
E.摇匀,发现液面低于刻度线又向容量瓶中滴加蒸馏水至刻度线
(Ⅱ)某100mL溶液只含Cu2+、Ba2+、K+、OH-、SO 、Cl-中的几种,分别取三份10mL该溶液进行实验,以确定该溶液中的离子组成。
、Cl-中的几种,分别取三份10mL该溶液进行实验,以确定该溶液中的离子组成。
①向一份中加入足量 NaOH 溶液,产生0.98g蓝色沉淀
②向另一份中加入足量BaCl2溶液,产生2.33g白色沉淀
③向第三份中加入过量Ba(NO3)2溶液,过滤取滤液再加入足量AgNO3溶液,产生2.87g白色沉淀。
回答下列问题:
(4)该溶液中一定不存在的离子是_______ ,该溶液中一定存在的阴离子有_______ 。
(5)该100mL溶液中除上述确定的离子外还含有的离子是_______ ,其物质的量是_______ ,请将检测该离子的实验操作方法补充完整:用洁净的铂丝蘸取试样(固体也可以直接蘸取)在无色火焰上灼烧,然后_______ 现象,证明存在该离子。
(Ⅰ)新冠肺炎疫情期间,“84消毒液”被广泛应用于物体表面杀菌消毒。高一某学习小组的同学参阅“84消毒液”的配方,欲用NaClO固体配制一定物质的量浓度的NaClO消毒液。
(1)下图是小组在实验室配制该NaClO溶液的过程示意图,其中有错误的是
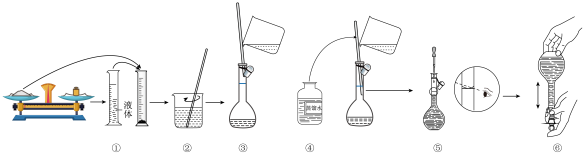
(3)若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是
A.配制前,容量瓶中有少量蒸馏水
B.未冷却,立即转移至容量瓶定容
C.定容时,仰视溶液的凹液面
D.量取浓硫酸时,仰视液体的凹液面
E.摇匀,发现液面低于刻度线又向容量瓶中滴加蒸馏水至刻度线
(Ⅱ)某100mL溶液只含Cu2+、Ba2+、K+、OH-、SO
 、Cl-中的几种,分别取三份10mL该溶液进行实验,以确定该溶液中的离子组成。
、Cl-中的几种,分别取三份10mL该溶液进行实验,以确定该溶液中的离子组成。①向一份中加入足量 NaOH 溶液,产生0.98g蓝色沉淀
②向另一份中加入足量BaCl2溶液,产生2.33g白色沉淀
③向第三份中加入过量Ba(NO3)2溶液,过滤取滤液再加入足量AgNO3溶液,产生2.87g白色沉淀。
回答下列问题:
(4)该溶液中一定不存在的离子是
(5)该100mL溶液中除上述确定的离子外还含有的离子是
您最近一年使用:0次