1 . 为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了下图实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。
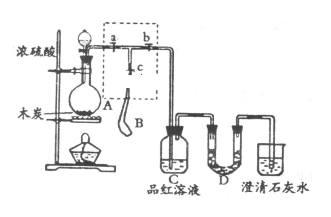
请回答下列问题:
(1)实验前需进行的操作是_______________________________
(2)写出圆底烧瓶中所发生的反应方程式____________________________________________
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________ (用编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________
(5)当D中产生______ (用字母填写)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为____________________ 。

请回答下列问题:
(1)实验前需进行的操作是
(2)写出圆底烧瓶中所发生的反应方程式
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为
(5)当D中产生
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为
您最近一年使用:0次
2018-12-23更新
|
203次组卷
|
2卷引用:山东省夏津一中2018-2019学年高一上学期12月月考化学试题
2018高三·全国·专题练习
2 . 实验室用废铜屑和稀硝酸反应制备无水硝酸铜,下列装置能达到实验目的的是( )
A.制备硝酸铜溶液 | B.吸收尾气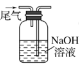 | C.加热蒸干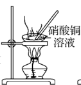 | D.脱去结晶水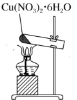 |
您最近一年使用:0次
2018-12-15更新
|
519次组卷
|
3卷引用:2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第4讲 氮及其化合物 (题型专练)
(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第4讲 氮及其化合物 (题型专练)沪科版高二化学拓展性课程9《化学实验探究》测试题江苏省百校联考2023-2024学年高三上学期第二次考试化学试题
3 . 下列实验装置的有关说法正确的是
|
|
A.用该装置可以模拟侯氏制碱法制备 | B.该装置的优点只是节约试剂 |
|
|
| C.通过该装置实验现象可以验证金属活泼性Zn>Cu | D.量筒内颜色变浅说明 与 与 发生了取代反应 发生了取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 下列装置能达到相应实验目的的是
A.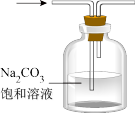 除去CO2中的HCl 除去CO2中的HCl |
B. 制备Fe(OH)2并能较长时间观察其颜色 制备Fe(OH)2并能较长时间观察其颜色 |
C. 验证碳酸的酸性强于硅酸 验证碳酸的酸性强于硅酸 |
D.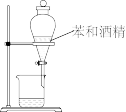 分离苯和酒精 分离苯和酒精 |
您最近一年使用:0次
2016-12-09更新
|
682次组卷
|
3卷引用:2017届山东省淄博实验中学高三上第一次教学诊断化学卷
名校
解题方法
5 . 三氯化氮(NCl3)为黄色油状液体,在弱酸性溶液中稳定,易溶于有机溶剂,在热水中易水解,95℃以上易爆炸,常用作漂白剂和杀菌剂。实验室常用Cl2与铵盐溶液反应制备,反应装置如图所示(夹持装置略)。
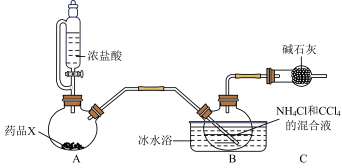
(1)若用装置A制取氯气,X药品为KMnO4,则A中反应的离子方程式是_______ 。
(2)装置C的作用为_______ ,B中冰水浴的目的是_______ ,B中Cl2与NH4Cl充分反应后,采用_______ (填操作名称)得到NCl3的四氯化碳溶液,经系列操作后,将制取得到的NCl3
(3)反应生成的NCl3遇热水易水解,反应液有漂白性,产生的气体能让湿润的红色石蕊试纸变蓝。写出NCl3水解的化学方程式:_______ 。
(4)NCl3浓度测定:NCl3的制取是可逆反应,根据反应 ,利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:
,利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:
ⅰ.准确量取30.00mLNCl3的(NH4)2SO4溶液于三颈烧瓶中,加入10mL足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200mL0.1mol/LKI溶液中,待装置中无色液体变成黄色,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取20.00mL吸收液,加入淀粉指示剂,用0.1mol/LNa2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液18.00mL。(已知:反应原理为 )
)
①确定滴定终点的现象为_______ 。
②NCl3的(NH4)2SO4溶液中,NCl3的浓度为_______ mol·L-1

(1)若用装置A制取氯气,X药品为KMnO4,则A中反应的离子方程式是
(2)装置C的作用为
(3)反应生成的NCl3遇热水易水解,反应液有漂白性,产生的气体能让湿润的红色石蕊试纸变蓝。写出NCl3水解的化学方程式:
(4)NCl3浓度测定:NCl3的制取是可逆反应,根据反应
 ,利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:
,利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:ⅰ.准确量取30.00mLNCl3的(NH4)2SO4溶液于三颈烧瓶中,加入10mL足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200mL0.1mol/LKI溶液中,待装置中无色液体变成黄色,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取20.00mL吸收液,加入淀粉指示剂,用0.1mol/LNa2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液18.00mL。(已知:反应原理为
 )
)①确定滴定终点的现象为
②NCl3的(NH4)2SO4溶液中,NCl3的浓度为
您最近一年使用:0次
2023-12-01更新
|
131次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二上学期11月期中考试化学试题
名校
6 . 硫氰酸钾 是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
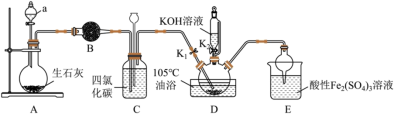
已知:D中三颈烧瓶内盛放 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 高于170℃时易分解,
高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。
(1)B中装有的物质为_______ (写名称),D中盛装 溶液的仪器名称为
溶液的仪器名称为_______ ,E中球形干燥管的作用为_______ 。
(2)制备 溶液:将D中反应混合液加热至105℃,打开
溶液:将D中反应混合液加热至105℃,打开 通入氨气。反应一段时间后,关闭
通入氨气。反应一段时间后,关闭 ,保持三颈烧瓶内反应混合液温度为105℃一段时间,该过程的目的为
,保持三颈烧瓶内反应混合液温度为105℃一段时间,该过程的目的为_______ ;打开 ,缓缓滴入适量的
,缓缓滴入适量的 溶液,继续保持反应混合液温度为105℃。
溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是_______ 。
(4)将制备所得硫氰酸钾晶体进行 含量的测定:称取
含量的测定:称取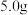 样品,配成
样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 ,用
,用 标准溶液滴定,平行滴定四次,消耗标准溶液体积分别为
标准溶液滴定,平行滴定四次,消耗标准溶液体积分别为 ,
, 、
、 、
、 。[已知:滴定时发生的反应为
。[已知:滴定时发生的反应为 白色]
白色]
①滴定终点的现象为_______ 。
②晶体中 的质量分数为
的质量分数为_______ ( 的摩尔质量为
的摩尔质量为 )。
)。
③下列操作或说法正确的是_______ (填标号)。
A.用量筒量取 溶液于锥形瓶中
溶液于锥形瓶中
B.锥形瓶洗净后未干燥,会导致测定结果偏低
C.读数时可以将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.滴定前平视读数,滴定后仰视读数,会导致测定结果偏高
 是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
已知:D中三颈烧瓶内盛放
 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 高于170℃时易分解,
高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。(1)B中装有的物质为
 溶液的仪器名称为
溶液的仪器名称为(2)制备
 溶液:将D中反应混合液加热至105℃,打开
溶液:将D中反应混合液加热至105℃,打开 通入氨气。反应一段时间后,关闭
通入氨气。反应一段时间后,关闭 ,保持三颈烧瓶内反应混合液温度为105℃一段时间,该过程的目的为
,保持三颈烧瓶内反应混合液温度为105℃一段时间,该过程的目的为 ,缓缓滴入适量的
,缓缓滴入适量的 溶液,继续保持反应混合液温度为105℃。
溶液,继续保持反应混合液温度为105℃。(3)装置E中发生氧化还原反应的离子方程式是
(4)将制备所得硫氰酸钾晶体进行
 含量的测定:称取
含量的测定:称取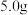 样品,配成
样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 ,用
,用 标准溶液滴定,平行滴定四次,消耗标准溶液体积分别为
标准溶液滴定,平行滴定四次,消耗标准溶液体积分别为 ,
, 、
、 、
、 。[已知:滴定时发生的反应为
。[已知:滴定时发生的反应为 白色]
白色]①滴定终点的现象为
②晶体中
 的质量分数为
的质量分数为 的摩尔质量为
的摩尔质量为 )。
)。③下列操作或说法正确的是
A.用量筒量取
 溶液于锥形瓶中
溶液于锥形瓶中B.锥形瓶洗净后未干燥,会导致测定结果偏低
C.读数时可以将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.滴定前平视读数,滴定后仰视读数,会导致测定结果偏高
您最近一年使用:0次
名校
7 . 甘氨酸亚铁是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某化学兴趣小组通过先寻找高纯度 的最佳制备方案,再利用制取的高纯度
的最佳制备方案,再利用制取的高纯度 和甘氨酸反应,最后得到了甘氨酸亚铁,具体过程如下:
和甘氨酸反应,最后得到了甘氨酸亚铁,具体过程如下:
(一)制取 并寻找最佳制备方案
并寻找最佳制备方案
(1)实验中红褐色沉淀产生的原因可用如下反应表示,请补全反应:___________ 。

(2)实验II中产生 的离子方程式为
的离子方程式为___________ 。
(3)为了探究实验III中 起的作用,甲同学设计了实验IV进行探究:
起的作用,甲同学设计了实验IV进行探究:
对比实验II、III、IV,甲同学得出结论:___________ 。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:___________ ,再取该溶液一滴管,与 溶液混合。
溶液混合。
实验证明:实验是制取高纯度 的最佳方案。
的最佳方案。
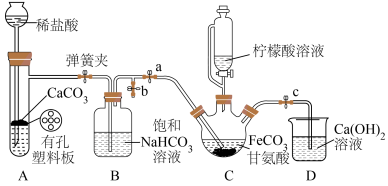
(二)制取甘氨酸亚铁(夹持和加热仪器已省略)
(4)装置C盛有 和
和 甘氨酸溶液。实验时,先排尽装置C内空气,再加热搅拌,然后滴加柠檬酸溶液调节溶液的
甘氨酸溶液。实验时,先排尽装置C内空气,再加热搅拌,然后滴加柠檬酸溶液调节溶液的 ,
, 过低或过高都会导致甘氨酸亚铁产率下降,其原因是
过低或过高都会导致甘氨酸亚铁产率下降,其原因是___________ 。
(5)反应结束后过滤,将滤液进行蒸发浓缩;并加入无水乙醇,其作用是___________ 。
(6)再进行过滤、洗涤并干燥并称量,最后得到 甘氨酸亚铁(
甘氨酸亚铁( ),则其产率是
),则其产率是___________ 。
 的最佳制备方案,再利用制取的高纯度
的最佳制备方案,再利用制取的高纯度 和甘氨酸反应,最后得到了甘氨酸亚铁,具体过程如下:
和甘氨酸反应,最后得到了甘氨酸亚铁,具体过程如下:(一)制取
 并寻找最佳制备方案
并寻找最佳制备方案| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
|  溶液( 溶液( ) ) |  溶液( 溶液( ) ) | 实验I:立即产生灰绿色沉淀, 后出现明显的红褐色 后出现明显的红褐色 |
 溶液( 溶液( ) ) |  溶液( 溶液( ) ) | 实验II:产生白色沉淀及少量无色气泡, 后出现明显的灰绿色。 后出现明显的灰绿色。 | |
 溶液( 溶液( ) ) |  溶液( 溶液( ) ) | 实验III:产生白色沉淀及无色气泡,较长时间保持白色 | |

(2)实验II中产生
 的离子方程式为
的离子方程式为(3)为了探究实验III中
 起的作用,甲同学设计了实验IV进行探究:
起的作用,甲同学设计了实验IV进行探究:| 操作 | 现象 | |
| 实验IV | 向 溶液中加入硫酸调节溶液 溶液中加入硫酸调节溶液 为4.0,再加入一定量 为4.0,再加入一定量 固体配制成含 固体配制成含 的混合溶液(已知 的混合溶液(已知 对实验无影响)。再取该溶液一滴管与 对实验无影响)。再取该溶液一滴管与 溶液混合。 溶液混合。 | 与实验III现象相同 |
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:
 溶液混合。
溶液混合。实验证明:实验是制取高纯度
 的最佳方案。
的最佳方案。(二)制取甘氨酸亚铁(夹持和加热仪器已省略)
①甘氨酸(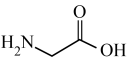 )易溶于水,微溶于乙醇。
)易溶于水,微溶于乙醇。
②甘氨酸亚铁(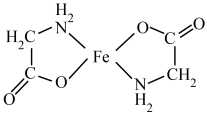 )易溶于水,难溶于乙醇。
)易溶于水,难溶于乙醇。
③柠檬酸( )易溶于水和乙醇,具有较强的还原性和酸性。
)易溶于水和乙醇,具有较强的还原性和酸性。
(4)装置C盛有
 和
和 甘氨酸溶液。实验时,先排尽装置C内空气,再加热搅拌,然后滴加柠檬酸溶液调节溶液的
甘氨酸溶液。实验时,先排尽装置C内空气,再加热搅拌,然后滴加柠檬酸溶液调节溶液的 ,
, 过低或过高都会导致甘氨酸亚铁产率下降,其原因是
过低或过高都会导致甘氨酸亚铁产率下降,其原因是(5)反应结束后过滤,将滤液进行蒸发浓缩;并加入无水乙醇,其作用是
(6)再进行过滤、洗涤并干燥并称量,最后得到
 甘氨酸亚铁(
甘氨酸亚铁( ),则其产率是
),则其产率是
您最近一年使用:0次
名校
解题方法
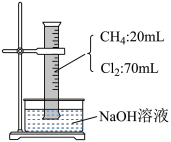
8 . 某校化学兴趣小组为研究Cl2 的性质,设计如图所示装置进行实验,装置Ⅲ中夹持装置已略去,其中a 为干燥的品红试纸,b 为湿润的品红试纸。
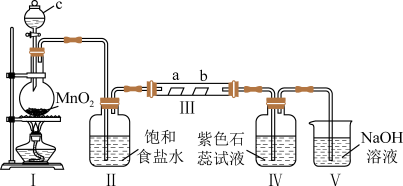
(1)实验室以二氧化锰和浓盐酸制备 Cl2 的化学方程式为___________ 。
(2)仪器c 的名称为___________ ,装置Ⅱ的作用是___________ 。
(3)若产生的Cl2 足量,实验过程中装置Ⅳ的实验现象为___________ 。
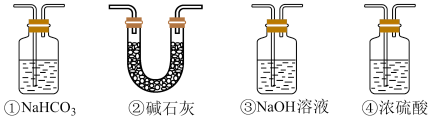
(4)实验结束后,该组同学在装置Ⅲ中观察到 b 的红色褪去,但是并未观察到“a 无明显变化”这一预期现象,为达到这一目的,你认为还需在装置Ⅱ与Ⅲ之间添加图中的_______ 装置(填序号)。

(1)实验室以二氧化锰和浓盐酸制备 Cl2 的化学方程式为
(2)仪器c 的名称为
(3)若产生的Cl2 足量,实验过程中装置Ⅳ的实验现象为
(4)实验结束后,该组同学在装置Ⅲ中观察到 b 的红色褪去,但是并未观察到“a 无明显变化”这一预期现象,为达到这一目的,你认为还需在装置Ⅱ与Ⅲ之间添加图中的

您最近一年使用:0次
名校
解题方法
9 . 某化学兴趣小组设计了研究溴苯制备原理并检验产物的实验,部分物质数据如下:苯密度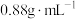 ,沸点
,沸点 ℃:溴苯密度
℃:溴苯密度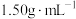 ,沸点
,沸点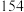 ℃。请回答下列问题:
℃。请回答下列问题:
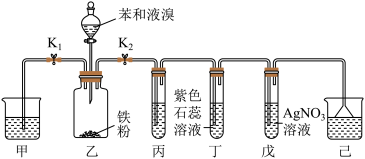
I.粗溴苯的制备
按如图所示的装置连接好各仪器,经检查气密性良好后,加入相应试剂。_______ 。
(2)溴苯的制备需在无水条件下进行,原因是_______ 。
(3)装置丙中应该盛装_______ (填试剂名称)。能够证明该反应为取代反应的实验现象为_______ ;若撤去装置丙,_______ (填“能”或“不能”)证明该反应为取代反应。
Ⅱ.溴苯的精制如下图所示: 溶液洗涤时,反应的离子方程式为
溶液洗涤时,反应的离子方程式为_______ 。
(5)有机层Ⅲ经干燥后分离出纯净溴苯的操作为_______ (填操作名称)。
(6)若实验时使用 苯,最终精制得到
苯,最终精制得到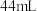 溴苯,则溴苯的产率为
溴苯,则溴苯的产率为_______ (保留两位有效数字)。
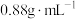 ,沸点
,沸点 ℃:溴苯密度
℃:溴苯密度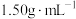 ,沸点
,沸点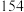 ℃。请回答下列问题:
℃。请回答下列问题:I.粗溴苯的制备
按如图所示的装置连接好各仪器,经检查气密性良好后,加入相应试剂。
(2)溴苯的制备需在无水条件下进行,原因是
(3)装置丙中应该盛装
Ⅱ.溴苯的精制如下图所示:
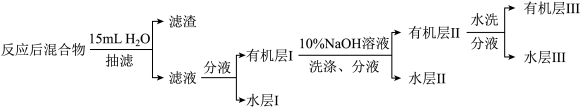
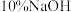 溶液洗涤时,反应的离子方程式为
溶液洗涤时,反应的离子方程式为(5)有机层Ⅲ经干燥后分离出纯净溴苯的操作为
(6)若实验时使用
 苯,最终精制得到
苯,最终精制得到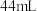 溴苯,则溴苯的产率为
溴苯,则溴苯的产率为
您最近一年使用:0次
2023-07-12更新
|
633次组卷
|
3卷引用:山东省日照市2022-2023学年高二下学期期末考试化学试题
名校
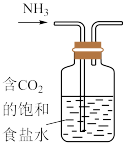
10 . 氯气与氢氧化钠溶液反应后得到的溶液称为“84消毒液”,常用于日用品消毒,也可用于有色污渍的漂白。
(1)利用家中常见物品可以自制少量“84消毒液”。甲同学设计了如下几种装置(装置内盛放的均为饱和食盐水),其中适宜的是___________。
(2)写出利用该装置制备“84消毒液”总反应的化学方程式___________ 。
(3)“84消毒液”使用时应按比例稀释,放置20~30min。放置过程中生成碳酸氢钠,该反应的离子方程式为___________ 。
(4)在日常生活中,严禁将“84消毒液”与洁厕灵(主要成分为盐酸)混用,以免产生有毒气体,其原理可以表示为:NaClO+2HCl=NaCl+Cl2↑+H2O,该反应中盐酸体现的性质是___________ 。
乙同学取少量“84”消毒液置于试管中,滴加过氧化氢后,有大量气泡生成,经检验生成的气体为氧气。
(5)乙同学对氧气的来源作出如下猜想:
猜想一:次氯酸钠作氧化剂,氧化过氧化氢产生氧气;
猜想二:次氯酸钠作___________ ,促使过氧化氢分解产生氧气。
(6)乙同学向反应后溶液中加入足量稀硝酸,再滴加硝酸银溶液,观察到有白色沉淀生成。由此他认为次氯酸钠被还原,猜想一成立。但丙同学结合“84”消毒液的生产原理判断仅凭该实验现象不能认为猜想一成立,理由是:___________ 。
丙同学量取30mL“84”消毒液,将15mL过氧化氢溶液平均分成3份后依次加入,测定每次加入后产生氧气的体积,结果如下(假设每次反应均充分进行,忽略其他因素对测量结果的干扰):
(7)根据上述实验结果判断哪种猜想成立并说明理由。___________ 。
丁同学想要探究“84消毒液”(以下简称“84”,pH约为11)是否可以漂白黑褐色的陈醋(主要成分为醋酸CH3COOH,pH约为2.3),进行如下实验:
已知“84”中有效氯的主要存在形态与溶液pH的关系如表所示:;
(8)用离子方程式表示实验②中产生漂白性物质的原理:___________ 。
(9)结合上述实验和相关资料,解释实验①与实验②现象的差异:___________ 。
(1)利用家中常见物品可以自制少量“84消毒液”。甲同学设计了如下几种装置(装置内盛放的均为饱和食盐水),其中适宜的是___________。
A. | B.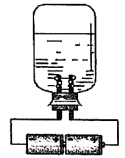 |
C.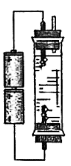 | D. |
(3)“84消毒液”使用时应按比例稀释,放置20~30min。放置过程中生成碳酸氢钠,该反应的离子方程式为
(4)在日常生活中,严禁将“84消毒液”与洁厕灵(主要成分为盐酸)混用,以免产生有毒气体,其原理可以表示为:NaClO+2HCl=NaCl+Cl2↑+H2O,该反应中盐酸体现的性质是
乙同学取少量“84”消毒液置于试管中,滴加过氧化氢后,有大量气泡生成,经检验生成的气体为氧气。
(5)乙同学对氧气的来源作出如下猜想:
猜想一:次氯酸钠作氧化剂,氧化过氧化氢产生氧气;
猜想二:次氯酸钠作
(6)乙同学向反应后溶液中加入足量稀硝酸,再滴加硝酸银溶液,观察到有白色沉淀生成。由此他认为次氯酸钠被还原,猜想一成立。但丙同学结合“84”消毒液的生产原理判断仅凭该实验现象不能认为猜想一成立,理由是:
丙同学量取30mL“84”消毒液,将15mL过氧化氢溶液平均分成3份后依次加入,测定每次加入后产生氧气的体积,结果如下(假设每次反应均充分进行,忽略其他因素对测量结果的干扰):
| 加入5mL过氧化氢溶液 | 第1次 | 第2次 | 第3次 |
| 产生氧气体积/mL | 135 | 135 | 85 |
丁同学想要探究“84消毒液”(以下简称“84”,pH约为11)是否可以漂白黑褐色的陈醋(主要成分为醋酸CH3COOH,pH约为2.3),进行如下实验:
| 编号 | 实验操作 | 实验现象 |
| ① | 取10滴陈醋,逐滴加入21滴“84” | “84”滴入后迅速产生较多刺激性气味的气体;滴加至5滴时,溶液开始褪色;滴加完毕时,溶液褪为淡黄色。 |
| ② | 取21滴“84”,逐滴加入10滴陈醋 | 滴入陈醋后立即褪色;滴加完毕时,溶液颜色较实验①更浅。 |
| pH | <2.5 | 2.5~3.5 | 3.5~5 | 5~9 | >9 |
| 存在形态 | Cl2 | Cl2、HClO | HClO | HClO、ClO- | ClO- |
(9)结合上述实验和相关资料,解释实验①与实验②现象的差异:
您最近一年使用:0次