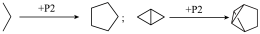1 . Ⅰ.已知一种金属M的化合价只有+2、+4,且+4价的M具有强氧化性,能氧化浓HCl生成Cl2;MO2不稳定,随温度升高按下列顺序逐步分解:MO2→M2O3→M3O4→MO。现将xmolMO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2.加热反应后所得固体中,M2+占M元素的物质的量分数为a;两步反应中收集的O2和Cl2的物质的量之和为bmol。请回答:
(1)通过计算确定b与x、a的函数关系式___________ 。
(2)两步反应中O2和Cl2的物质的量之比为2∶1,则加热后所得固体中含有的物质及其物质的量之比为___________ 。
Ⅱ.已知常温下CaC2O4的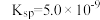 ,H2C2O4的
,H2C2O4的 、
、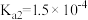 。把CaC2O4固体溶于pH=4.8的CH3COOH和CH3COONa的缓冲溶液中形成饱和溶液。
。把CaC2O4固体溶于pH=4.8的CH3COOH和CH3COONa的缓冲溶液中形成饱和溶液。
(3)求该饱和溶液中Ca2+的浓度为___________ mol/L。
(1)通过计算确定b与x、a的函数关系式
(2)两步反应中O2和Cl2的物质的量之比为2∶1,则加热后所得固体中含有的物质及其物质的量之比为
Ⅱ.已知常温下CaC2O4的
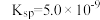 ,H2C2O4的
,H2C2O4的 、
、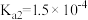 。把CaC2O4固体溶于pH=4.8的CH3COOH和CH3COONa的缓冲溶液中形成饱和溶液。
。把CaC2O4固体溶于pH=4.8的CH3COOH和CH3COONa的缓冲溶液中形成饱和溶液。(3)求该饱和溶液中Ca2+的浓度为
您最近一年使用:0次
解题方法
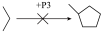
2 . X是一种由4种短周期元素组成含结晶水的盐。某兴趣小组按如下流程进行实验(所用试剂均足量):
请回答:
(1)组成X的元素有___________ ,X的化学式为___________ 。
(2)混合气体A中的成分是(用化学式表示):___________ 。
(3)溶液D中的溶质与新制Cu(OH)2悬浊液反应的离子反应方程式是___________ 。
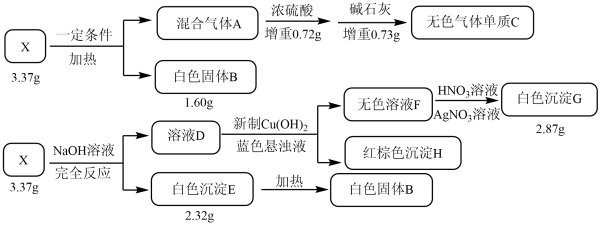
请回答:
(1)组成X的元素有
(2)混合气体A中的成分是(用化学式表示):
(3)溶液D中的溶质与新制Cu(OH)2悬浊液反应的离子反应方程式是
您最近一年使用:0次
3 . 瑞典皇家科学院近日宣布:2023年诺贝尔化学奖授予了三位美国化学家,以表彰他们在发现和合成量子点方面作出的贡献,合成量子点是一种制造半导体纳米晶体(NCs)的方法,这些半导体纳米晶体具有独特的电子和发光性质。根据你所学的知识,下列关于量子点的说法不正确的是

| A.有机合成:量子点可以构建各种共价键,从而合成复杂的化学分子 |
| B.发光二极管:量子点可以作为发光材料,制造出高效、低能耗的发光二极管 |
| C.图像传感器:量子点可以提高图像传感器的灵敏度和性能,帮助捕捉更高质量的照片和视频 |
| D.太阳能电池:量子点可以提高太阳能电池的光电转换效率,帮助太阳能电池更有效地吸收和利用光能 |
您最近一年使用:0次
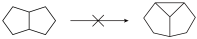
4 . 两个平面型 双核铜簇骼单元(结构如下图所示)可通过四个
双核铜簇骼单元(结构如下图所示)可通过四个 键形成立方烷型
键形成立方烷型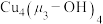 四核铜筷骼单元A,也可通过
四核铜筷骼单元A,也可通过 键二聚形成阶梯型
键二聚形成阶梯型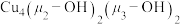 四核铜族骼各单元B,以上述两种方式继续组装,可以得到具有更多核数的簇骼单元。
四核铜族骼各单元B,以上述两种方式继续组装,可以得到具有更多核数的簇骼单元。
(1)画出A和B的结构_______ 。
(2)以碱式碳酸铜、2,2′-联吡啶(bpy)与己二酸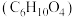 反应,可以得到含有阶梯型六核铜簇骼单元的配合物
反应,可以得到含有阶梯型六核铜簇骼单元的配合物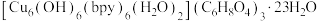 ,其中的配离子呈中心对称,每个铜离子均处于
,其中的配离子呈中心对称,每个铜离子均处于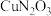 四方锥配位环境中。画出该配离子的结构
四方锥配位环境中。画出该配离子的结构_______ 。(用 代表bpy配体)
代表bpy配体)
 双核铜簇骼单元(结构如下图所示)可通过四个
双核铜簇骼单元(结构如下图所示)可通过四个 键形成立方烷型
键形成立方烷型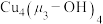 四核铜筷骼单元A,也可通过
四核铜筷骼单元A,也可通过 键二聚形成阶梯型
键二聚形成阶梯型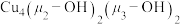 四核铜族骼各单元B,以上述两种方式继续组装,可以得到具有更多核数的簇骼单元。
四核铜族骼各单元B,以上述两种方式继续组装,可以得到具有更多核数的簇骼单元。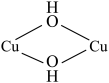

(1)画出A和B的结构
(2)以碱式碳酸铜、2,2′-联吡啶(bpy)与己二酸
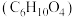 反应,可以得到含有阶梯型六核铜簇骼单元的配合物
反应,可以得到含有阶梯型六核铜簇骼单元的配合物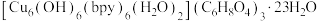 ,其中的配离子呈中心对称,每个铜离子均处于
,其中的配离子呈中心对称,每个铜离子均处于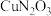 四方锥配位环境中。画出该配离子的结构
四方锥配位环境中。画出该配离子的结构 代表bpy配体)
代表bpy配体)
您最近一年使用:0次
5 . 脂类物质的氧化是油脂保存过程中广泛存在的问题。亚油酸乙酯(记为RH)的氧化过程属于自由基氧化反应,其中H代表最可能发生氧化反应的氢原子。反应方程式如下: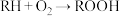
(1)亚油酸的学名是(9Z,12Z)-9,12-十八碳二烯酸,画出亚油酸乙酯的结构式,并用“*”标记最可能发生自由基氧化反应的氢原子_______ 。
(2)实验测得反应的速率方程如下:
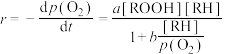 (1)
(1)
其中,a、b是与浓度无关的常数。该反应的基元反应步骤如下表所示,其中, 到
到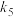 分别为相应基元反应的速率常数,链传递步骤是整个反应的决速步。氧气分压
分别为相应基元反应的速率常数,链传递步骤是整个反应的决速步。氧气分压 较高时主要按照①、②、④步骤进行:
较高时主要按照①、②、④步骤进行: 较低时主要按照①、③、⑤步骤进行。据此,分别在两种情况下推导反应的速率方程,并解释在
较低时主要按照①、③、⑤步骤进行。据此,分别在两种情况下推导反应的速率方程,并解释在 较高和较低的情况下(1)式如何近似得出这两种速率方程
较高和较低的情况下(1)式如何近似得出这两种速率方程_______ 。
(3)实验测得反应的表观活化能在 较高时为
较高时为 ,
, 较低时为
较低时为 。根据(2)中推导出的两种速率方程,指出两种情况下,分别是哪步的活化能决定了总反应的表观活化能?
。根据(2)中推导出的两种速率方程,指出两种情况下,分别是哪步的活化能决定了总反应的表观活化能?_______ (提示:自由基相互结合的反应活化能通常近似为0)
(4)某种酶对上述反应的催化速率常数k随温度变化的关系如表所示。其中,下标中的H或D分别表示8-1中亚油酸乙酯上相应氢原子均是氕(H)或氘(D)原子。计算氕(H)原子情况下的表观活化能_______ 。
(5)动力学同位素效应(KIE)指的是把反应物分子中的某一原子用其同位素原子取代后,反应速率常数变化的效应。一般用取代前后的速率常数之比衡量KIE的大小。计算(4)中各温度下的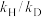 ,并选择影响
,并选择影响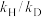 数值的主要因素
数值的主要因素_______ 。(直接在答题纸上填A或B)
A.指前因子 B.活化能
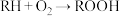
(1)亚油酸的学名是(9Z,12Z)-9,12-十八碳二烯酸,画出亚油酸乙酯的结构式,并用“*”标记最可能发生自由基氧化反应的氢原子
(2)实验测得反应的速率方程如下:
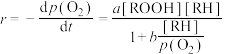 (1)
(1)其中,a、b是与浓度无关的常数。该反应的基元反应步骤如下表所示,其中,
 到
到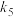 分别为相应基元反应的速率常数,链传递步骤是整个反应的决速步。氧气分压
分别为相应基元反应的速率常数,链传递步骤是整个反应的决速步。氧气分压 较高时主要按照①、②、④步骤进行:
较高时主要按照①、②、④步骤进行: 较低时主要按照①、③、⑤步骤进行。据此,分别在两种情况下推导反应的速率方程,并解释在
较低时主要按照①、③、⑤步骤进行。据此,分别在两种情况下推导反应的速率方程,并解释在 较高和较低的情况下(1)式如何近似得出这两种速率方程
较高和较低的情况下(1)式如何近似得出这两种速率方程| 链引发 | ①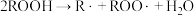 |  |
| 链传递 | ②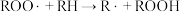 ③ 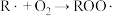 |  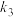 |
| 链终止 | ④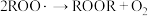 ⑤ 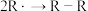 | 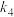 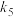 |
 较高时为
较高时为 ,
, 较低时为
较低时为 。根据(2)中推导出的两种速率方程,指出两种情况下,分别是哪步的活化能决定了总反应的表观活化能?
。根据(2)中推导出的两种速率方程,指出两种情况下,分别是哪步的活化能决定了总反应的表观活化能?(4)某种酶对上述反应的催化速率常数k随温度变化的关系如表所示。其中,下标中的H或D分别表示8-1中亚油酸乙酯上相应氢原子均是氕(H)或氘(D)原子。计算氕(H)原子情况下的表观活化能
| T/K | 293.15 | 323.15 |
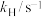 | 1.62 | 2.95 |
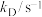 | 0.0111 | 0.0321 |
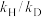 ,并选择影响
,并选择影响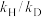 数值的主要因素
数值的主要因素A.指前因子 B.活化能
您最近一年使用:0次
6 . 化学史上最早的精密量热计是法国化学家拉瓦锡和物理学家拉普拉斯1780年发明的冰量热计,结构如下图所示,在三层空腔的最里层F放置已精确称重的待测物质进行反应,在中层 和外层
和外层 各堆积足够的冰块,各层之间由金属壳或金属网分隔开,整个装置用绝热的盖子B盖住。实验中,中层的冰不断熔化成水,后者完全从旋塞
各堆积足够的冰块,各层之间由金属壳或金属网分隔开,整个装置用绝热的盖子B盖住。实验中,中层的冰不断熔化成水,后者完全从旋塞 处流出,测得的热量用流出的水的质量来表示。
处流出,测得的热量用流出的水的质量来表示。
(1)冰量热计里,外层a处冰的作用主要是什么?_______
(2)早期化学家用冰量热计来研究碳(石墨形态)的燃烧热,实验结果如下表所示:
已知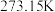 冰的标准熔化焓为
冰的标准熔化焓为 ,用计算说明碳的不完全燃烧是否可以解释他们实验结果的差异
,用计算说明碳的不完全燃烧是否可以解释他们实验结果的差异_______ 。
(3)冰的熔点受到多种因素影响。在水的相图上,水的三相点为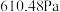 、
、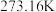 。已知金星表面大气压是地球表面的93.0倍,其大气中主要组成为
。已知金星表面大气压是地球表面的93.0倍,其大气中主要组成为 ,水的凝固点降低系数为
,水的凝固点降低系数为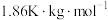 ,在金星表面的大气压下
,在金星表面的大气压下 在水中的质量分数约为7.50%,忽略压力对冰熔化焓的影响,计算金星表面冰的熔点
在水中的质量分数约为7.50%,忽略压力对冰熔化焓的影响,计算金星表面冰的熔点_______ 。
(4)为了改进量热计的密闭性,现代多用弹式量热计来测量燃烧热或爆炸热,其结构如下图所示,刚性结构4和5可以保证反应过程中容器体积不变。反应物装在燃烧皿6中,由电极3产生的电火花引燃。季戊四醇四硝酸酯(PETN)是一种用途广泛的军民两用固态炸药,其爆炸时无氧气参与,只生成液态水、 、
、 、
、 。在
。在 下,用弹式量热计测得
下,用弹式量热计测得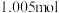 PETN爆炸反应的热效应为
PETN爆炸反应的热效应为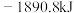 ,假设各气体均为理想气体,计算该温度下PETN的标准摩尔生成焓
,假设各气体均为理想气体,计算该温度下PETN的标准摩尔生成焓_______ 。
本题可能用到的热力学数据
 和外层
和外层 各堆积足够的冰块,各层之间由金属壳或金属网分隔开,整个装置用绝热的盖子B盖住。实验中,中层的冰不断熔化成水,后者完全从旋塞
各堆积足够的冰块,各层之间由金属壳或金属网分隔开,整个装置用绝热的盖子B盖住。实验中,中层的冰不断熔化成水,后者完全从旋塞 处流出,测得的热量用流出的水的质量来表示。
处流出,测得的热量用流出的水的质量来表示。
(1)冰量热计里,外层a处冰的作用主要是什么?
(2)早期化学家用冰量热计来研究碳(石墨形态)的燃烧热,实验结果如下表所示:
| 拉瓦锡 | 克劳福德 | 道尔顿 | |
| 熔化冰的质量/燃烧碳的质量 | 96.5 | 69 | 40 |
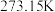 冰的标准熔化焓为
冰的标准熔化焓为 ,用计算说明碳的不完全燃烧是否可以解释他们实验结果的差异
,用计算说明碳的不完全燃烧是否可以解释他们实验结果的差异(3)冰的熔点受到多种因素影响。在水的相图上,水的三相点为
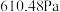 、
、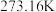 。已知金星表面大气压是地球表面的93.0倍,其大气中主要组成为
。已知金星表面大气压是地球表面的93.0倍,其大气中主要组成为 ,水的凝固点降低系数为
,水的凝固点降低系数为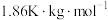 ,在金星表面的大气压下
,在金星表面的大气压下 在水中的质量分数约为7.50%,忽略压力对冰熔化焓的影响,计算金星表面冰的熔点
在水中的质量分数约为7.50%,忽略压力对冰熔化焓的影响,计算金星表面冰的熔点(4)为了改进量热计的密闭性,现代多用弹式量热计来测量燃烧热或爆炸热,其结构如下图所示,刚性结构4和5可以保证反应过程中容器体积不变。反应物装在燃烧皿6中,由电极3产生的电火花引燃。季戊四醇四硝酸酯(PETN)是一种用途广泛的军民两用固态炸药,其爆炸时无氧气参与,只生成液态水、
 、
、 、
、 。在
。在 下,用弹式量热计测得
下,用弹式量热计测得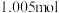 PETN爆炸反应的热效应为
PETN爆炸反应的热效应为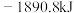 ,假设各气体均为理想气体,计算该温度下PETN的标准摩尔生成焓
,假设各气体均为理想气体,计算该温度下PETN的标准摩尔生成焓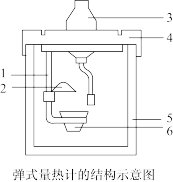
本题可能用到的热力学数据
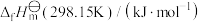 | 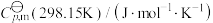 | 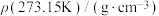 | |
| C(s,石墨) | 0 | 8.527 | |
 | 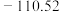 | 29.14 | |
 |  | 37.12 | |
 |  | 33.57 | |
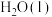 |  | 75.36 | 1.000 |
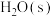 | 0.917 | ||
 | 0 | 29.355 |
您最近一年使用:0次
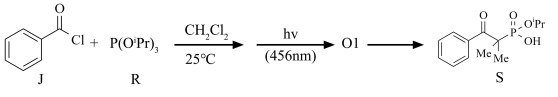
7 .  杂原子取代羰基化合物在天然产物和药物分子的合成中具有重要用途。酰胺化合物A在三氟甲磺酸酐
杂原子取代羰基化合物在天然产物和药物分子的合成中具有重要用途。酰胺化合物A在三氟甲磺酸酐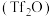 和2-碘吡啶
和2-碘吡啶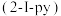 存在下,与手性亚磺酰胺试剂反应,生成
存在下,与手性亚磺酰胺试剂反应,生成 氨基酰胺化合物H.反应过程如下:
氨基酰胺化合物H.反应过程如下:_____ ;C_____ ;F_____ ;G_____ 。
(2)中间体D和E哪个形成更快?说明原因_____ 。
(3)画出G到H的过渡态结构_____ 。
(4)如下过程可用于α-经基酮的制备。该反应的关键在于中间体L的形成以及L中羰基在光激发下形成双自由基M。_____ 。
②中间体M和N都是双自由基,画出M、N和O的结构M_____ ;N_____ ;O_____ 。
③采用亚磷酸三异丙酯R作为反应底物时,可生成与O类似的O1中间体。画出用结构简式表述的O1到S的反应机理_____ 。_____ 。
 杂原子取代羰基化合物在天然产物和药物分子的合成中具有重要用途。酰胺化合物A在三氟甲磺酸酐
杂原子取代羰基化合物在天然产物和药物分子的合成中具有重要用途。酰胺化合物A在三氟甲磺酸酐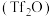 和2-碘吡啶
和2-碘吡啶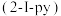 存在下,与手性亚磺酰胺试剂反应,生成
存在下,与手性亚磺酰胺试剂反应,生成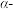 氨基酰胺化合物H.反应过程如下:
氨基酰胺化合物H.反应过程如下: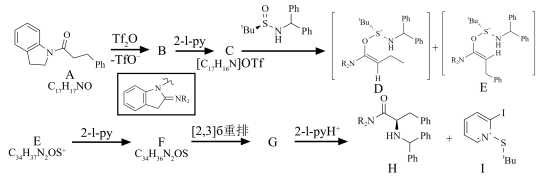
(2)中间体D和E哪个形成更快?说明原因
(3)画出G到H的过渡态结构
(4)如下过程可用于α-经基酮的制备。该反应的关键在于中间体L的形成以及L中羰基在光激发下形成双自由基M。
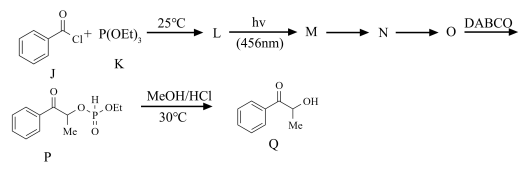
②中间体M和N都是双自由基,画出M、N和O的结构M
③采用亚磷酸三异丙酯R作为反应底物时,可生成与O类似的O1中间体。画出用结构简式表述的O1到S的反应机理
您最近一年使用:0次
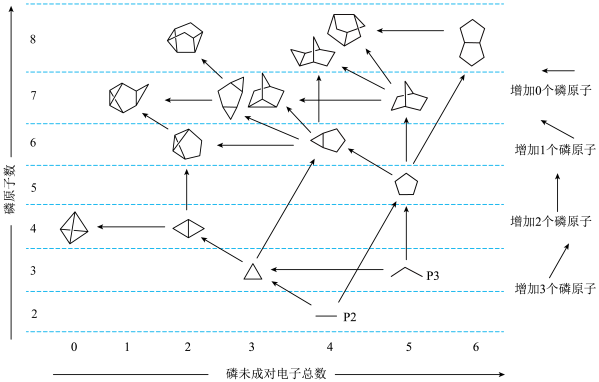
8 . 磷可以形成种类丰富的磷团簇。组成磷团簇的基本结构单元有两种:单键相连的两个磷原子P2(含有4个未配对电子)和链状的三个磷原子P3(含有5个未配对电子)。在基本结构单元基础上,应用以下三个规则可以形成多种磷团簇结构。下图中画出了未成对电子总数≤6和磷原子数≤8的所有情形,每个结构中顶点表示磷原子。
规则2:增加0或1个磷原子形成新团簇时必须通过磷原子桥成环的方式,且满足:
规则3:增加2或3个磷原子时只能通过“2+3”煡合,其中“2”和“3”至少要有一个P2或P3,且满足:
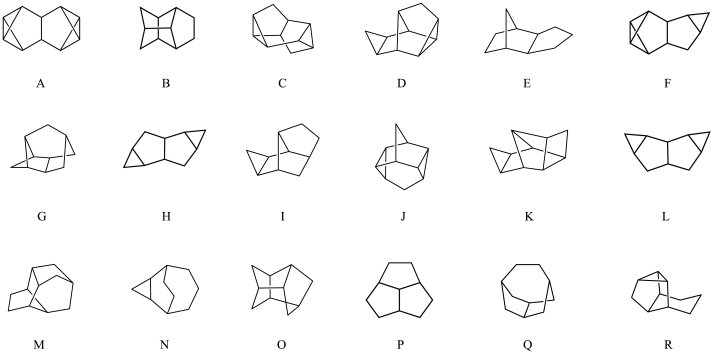
请在下列结构中选出满足上述磷团簇结构规则,由10个磷原子组成且未成对电子总数≥4的磷团簇。将编号填入答题纸的相应位置_______ 。(选错扣分,扣完本小题的分数为止)
规则2:增加0或1个磷原子形成新团簇时必须通过磷原子桥成环的方式,且满足:
| ①磷原子桥只包括零原子桥和一原子桥; ②形成新的原子桥时,不允许产生不含内键的四元环,例如:
| ③形成新的原子桥后,一定要存在两个磷原子数小于7的环,它们共用新形成的桥,且不共用其他任何原子。例如:
|
| ①若“2+3”中的“2”为P2,则其中的“3”必须是P3或来自于四元环或五元环中相连的3个磷,例如:
| ②成环后的结构不能有末端璘原子,例如:
|
您最近一年使用:0次
9 . 1937年,Hammett发现苯甲酸在水中的解离平衡受到其间位( )或对位(
)或对位(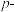 )取代基X的影响(平衡常数为
)取代基X的影响(平衡常数为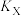 )。为了定量衡量取代基效应,Hammett定义了取代基常数
)。为了定量衡量取代基效应,Hammett定义了取代基常数 ,如下图中公式所示。若
,如下图中公式所示。若 小于0,说明取代基为给电子基团;若
小于0,说明取代基为给电子基团;若 大于0,说明取代基为吸电子基团。
大于0,说明取代基为吸电子基团。 绝对值的大小表示取代基给电子或吸电子能力的强弱。
绝对值的大小表示取代基给电子或吸电子能力的强弱。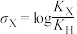
(1)已知25℃时,苯甲酸、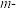 甲氧基苯甲酸和
甲氧基苯甲酸和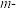 氟苯甲酸在水中的
氟苯甲酸在水中的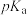 分别为4.21、4.09和3.87,计算
分别为4.21、4.09和3.87,计算 和
和 取代基的
取代基的 值:
值:_______ 。
(2)写出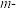 甲氧基苯甲酸中甲氧基主要表现出的电子效应_______。
甲氧基苯甲酸中甲氧基主要表现出的电子效应_______。
(3)以下反应是一个多步进行的离子型反应。
①定性描述反应速率k随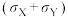 变化的趋势
变化的趋势_______ 。
②分别画出当 ,
, 时和
时和 ,
, 时决速步骤的反应式
时决速步骤的反应式_______ 。(可用Ar表示取代的苯基)
(4)取代苯甲酰氯水解反应的动力学数据如下,据此回答以下问题:
①定性描述溶剂1和溶剂2中反应速率k随 变化的趋势
变化的趋势_______ 。
②用结构简式分别画出对甲基苯甲酰氯(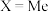 )在溶剂1和溶剂2中的反应机理,并解释溶剂对
)在溶剂1和溶剂2中的反应机理,并解释溶剂对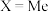 时反应机理的影响
时反应机理的影响_______ 。
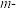 )或对位(
)或对位(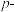 )取代基X的影响(平衡常数为
)取代基X的影响(平衡常数为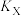 )。为了定量衡量取代基效应,Hammett定义了取代基常数
)。为了定量衡量取代基效应,Hammett定义了取代基常数 ,如下图中公式所示。若
,如下图中公式所示。若 小于0,说明取代基为给电子基团;若
小于0,说明取代基为给电子基团;若 大于0,说明取代基为吸电子基团。
大于0,说明取代基为吸电子基团。 绝对值的大小表示取代基给电子或吸电子能力的强弱。
绝对值的大小表示取代基给电子或吸电子能力的强弱。
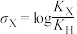
(1)已知25℃时,苯甲酸、
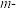 甲氧基苯甲酸和
甲氧基苯甲酸和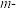 氟苯甲酸在水中的
氟苯甲酸在水中的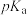 分别为4.21、4.09和3.87,计算
分别为4.21、4.09和3.87,计算 和
和 取代基的
取代基的 值:
值: |  |  | 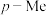 |  |  |  | 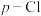 | 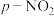 |
 | 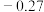 | 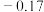 | 0 | 0.07 | 0.23 | 0.78 |
(2)写出
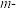 甲氧基苯甲酸中甲氧基主要表现出的电子效应_______。
甲氧基苯甲酸中甲氧基主要表现出的电子效应_______。| A.给电子诱导 | B.吸电子诱导 | C.给电子共轭 | D.吸电子共轭 |
(3)以下反应是一个多步进行的离子型反应。
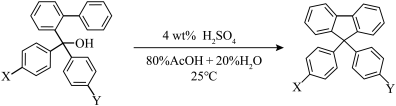
 |  |  |  |  |  |
 |  | 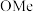 |  |  | 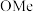 |
 |  |  | 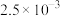 |  | 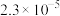 |
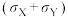 变化的趋势
变化的趋势②分别画出当
 ,
, 时和
时和 ,
, 时决速步骤的反应式
时决速步骤的反应式(4)取代苯甲酰氯水解反应的动力学数据如下,据此回答以下问题:
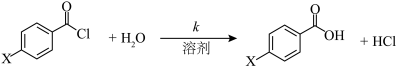
 |  |  |  |  |
溶剂1: 95%丙酮+5%水 | 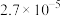 | 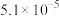 |  |  |
溶剂2: 50%丙酮+50%水 | 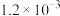 | 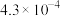 |  |  |
 变化的趋势
变化的趋势②用结构简式分别画出对甲基苯甲酰氯(
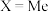 )在溶剂1和溶剂2中的反应机理,并解释溶剂对
)在溶剂1和溶剂2中的反应机理,并解释溶剂对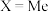 时反应机理的影响
时反应机理的影响
您最近一年使用:0次
10 . 向含有少量酚酞指示剂的水溶液中加入亚硫酸钠 、亚硫酸氢钠
、亚硫酸氢钠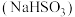 和甲酰
和甲酰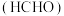 。经过一段时间后,溶液由无色突变为紫红色。发生该颜色突变所需的时间由上述三种试剂的初始浓度决定,因此,该体系被称为“甲醛时钟”。
。经过一段时间后,溶液由无色突变为紫红色。发生该颜色突变所需的时间由上述三种试剂的初始浓度决定,因此,该体系被称为“甲醛时钟”。
注:本题中温度为 ,溶液充分混匀,不考虑甲醛的水合反应。解题时可采取的近似原则为:如果
,溶液充分混匀,不考虑甲醛的水合反应。解题时可采取的近似原则为:如果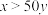 ,则
,则 可近似为
可近似为 。
。
(1)在中性水溶液中,甲醛可以与亚硫酸氢根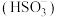 或亚硫酸根
或亚硫酸根 发生反应,生成一种酸性和碱性都很弱的一价负离子。分别写出甲醛与亚硫酸氢根反应、甲醛与亚硫酸根反应生成该一价负离子的离子方程式
发生反应,生成一种酸性和碱性都很弱的一价负离子。分别写出甲醛与亚硫酸氢根反应、甲醛与亚硫酸根反应生成该一价负离子的离子方程式_______ 。
(2)亚硫酸的第一级酸电离反应平衡常数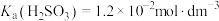 。为了计算亚硫酸的第二级酸电离反应平衡常数
。为了计算亚硫酸的第二级酸电离反应平衡常数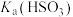 ,将
,将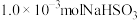 和
和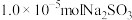 溶于水并定容至
溶于水并定容至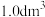 ,测得该溶液
,测得该溶液 值为5.36。
值为5.36。
①列出上述溶液的物料平衡方程式(亚硫酸的各形态)与电荷平衡方程式_______ 。
②计算上述溶液的亚硫酸根平衡浓度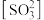 与亚硫酸氢根平衡浓度
与亚硫酸氢根平衡浓度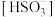
_______ 。
③计算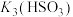 =
=_______ 。
(3)甲醛与亚硫酸氢根反应的速率常数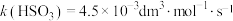 ,甲醛与亚硫酸根反应的速率常数
,甲醛与亚硫酸根反应的速率常数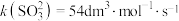 。酸碱电离和酸碱中和反应的速率很大,可认为是瞬时反应。某个甲醛时钟体系的各组分初始浓度分别为:甲醛
。酸碱电离和酸碱中和反应的速率很大,可认为是瞬时反应。某个甲醛时钟体系的各组分初始浓度分别为:甲醛 ,亚硫酸氢钠
,亚硫酸氢钠 ,亚硫酸钠
,亚硫酸钠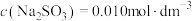 。
。
①该甲醛时钟初期阶段(溶液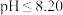 )的甲醛消耗速率
)的甲醛消耗速率 与甲醛平衡浓度
与甲醛平衡浓度 近似成正比,即经过合理近似后,
近似成正比,即经过合理近似后, ,其中
,其中 为常量。列出
为常量。列出 的计算式并算出
的计算式并算出 的数值
的数值_______ 。
②该甲醛时钟初期阶段的 值随时间
值随时间 近似线性增加,即经过合理近似后,
近似线性增加,即经过合理近似后, ,其中
,其中 为常量。列出
为常量。列出 的计算式并算出
的计算式并算出 的数值
的数值_______ 。
微分公式(其中 为常数,
为常数, 为标准浓度
为标准浓度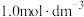 ):
):
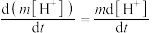

③已知存在下列平衡(其中 为甲醛与亚硫酸氢根或亚硫酸根的反应产物):
为甲醛与亚硫酸氢根或亚硫酸根的反应产物):
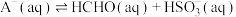
该反应的经验平衡常数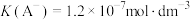 。该甲醛时钟达到颜色突变点时,溶液
。该甲醛时钟达到颜色突变点时,溶液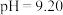 ,计算此时的
,计算此时的 =
=_______ 。
 、亚硫酸氢钠
、亚硫酸氢钠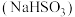 和甲酰
和甲酰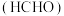 。经过一段时间后,溶液由无色突变为紫红色。发生该颜色突变所需的时间由上述三种试剂的初始浓度决定,因此,该体系被称为“甲醛时钟”。
。经过一段时间后,溶液由无色突变为紫红色。发生该颜色突变所需的时间由上述三种试剂的初始浓度决定,因此,该体系被称为“甲醛时钟”。注:本题中温度为
 ,溶液充分混匀,不考虑甲醛的水合反应。解题时可采取的近似原则为:如果
,溶液充分混匀,不考虑甲醛的水合反应。解题时可采取的近似原则为:如果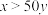 ,则
,则 可近似为
可近似为 。
。(1)在中性水溶液中,甲醛可以与亚硫酸氢根
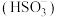 或亚硫酸根
或亚硫酸根 发生反应,生成一种酸性和碱性都很弱的一价负离子。分别写出甲醛与亚硫酸氢根反应、甲醛与亚硫酸根反应生成该一价负离子的离子方程式
发生反应,生成一种酸性和碱性都很弱的一价负离子。分别写出甲醛与亚硫酸氢根反应、甲醛与亚硫酸根反应生成该一价负离子的离子方程式(2)亚硫酸的第一级酸电离反应平衡常数
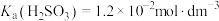 。为了计算亚硫酸的第二级酸电离反应平衡常数
。为了计算亚硫酸的第二级酸电离反应平衡常数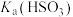 ,将
,将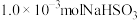 和
和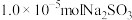 溶于水并定容至
溶于水并定容至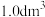 ,测得该溶液
,测得该溶液 值为5.36。
值为5.36。①列出上述溶液的物料平衡方程式(亚硫酸的各形态)与电荷平衡方程式
②计算上述溶液的亚硫酸根平衡浓度
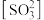 与亚硫酸氢根平衡浓度
与亚硫酸氢根平衡浓度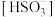
③计算
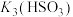 =
=(3)甲醛与亚硫酸氢根反应的速率常数
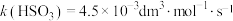 ,甲醛与亚硫酸根反应的速率常数
,甲醛与亚硫酸根反应的速率常数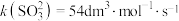 。酸碱电离和酸碱中和反应的速率很大,可认为是瞬时反应。某个甲醛时钟体系的各组分初始浓度分别为:甲醛
。酸碱电离和酸碱中和反应的速率很大,可认为是瞬时反应。某个甲醛时钟体系的各组分初始浓度分别为:甲醛 ,亚硫酸氢钠
,亚硫酸氢钠 ,亚硫酸钠
,亚硫酸钠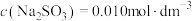 。
。①该甲醛时钟初期阶段(溶液
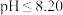 )的甲醛消耗速率
)的甲醛消耗速率 与甲醛平衡浓度
与甲醛平衡浓度 近似成正比,即经过合理近似后,
近似成正比,即经过合理近似后, ,其中
,其中 为常量。列出
为常量。列出 的计算式并算出
的计算式并算出 的数值
的数值②该甲醛时钟初期阶段的
 值随时间
值随时间 近似线性增加,即经过合理近似后,
近似线性增加,即经过合理近似后, ,其中
,其中 为常量。列出
为常量。列出 的计算式并算出
的计算式并算出 的数值
的数值微分公式(其中
 为常数,
为常数, 为标准浓度
为标准浓度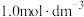 ):
):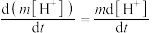

③已知存在下列平衡(其中
 为甲醛与亚硫酸氢根或亚硫酸根的反应产物):
为甲醛与亚硫酸氢根或亚硫酸根的反应产物):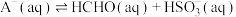
该反应的经验平衡常数
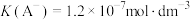 。该甲醛时钟达到颜色突变点时,溶液
。该甲醛时钟达到颜色突变点时,溶液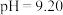 ,计算此时的
,计算此时的 =
=
您最近一年使用:0次