解题方法
1 . 以  为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:
I.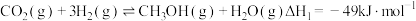
II.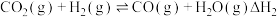
回答下列问题:
(1)已知 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、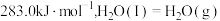
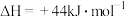 ,则∆H2=
,则∆H2=___________ kJ/mol。
(2)在恒压密闭容器中,按照 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
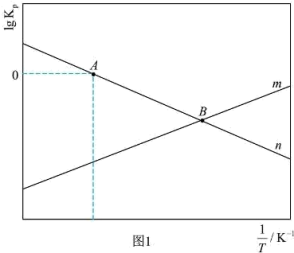
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为 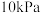 )。
)。 对应图1中
对应图1中___________ (填:“ ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=___________ kPa-2 (保留两位有效数字)。
②通过调整温度可调控平衡时 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= ___________ kPa 。
(3)在密闭容器中,保持投料比不变,将 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。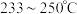 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则 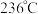 图中曲线下降的原因是
图中曲线下降的原因是___________ ;
②若气体流速过大, 的转化率会降低,原因是
的转化率会降低,原因是___________ 。
(4)向恒温恒压的两个密闭容器甲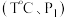 、乙
、乙 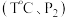 中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应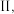 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 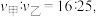 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为___________ 。
 为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:I.
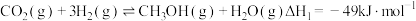
II.
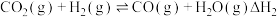
回答下列问题:
(1)已知
 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、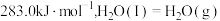
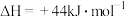 ,则∆H2=
,则∆H2=(2)在恒压密闭容器中,按照
 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为 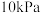 )。
)。
 对应图1中
对应图1中 ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=②通过调整温度可调控平衡时
 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= (3)在密闭容器中,保持投料比不变,将
 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。
 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则  图中曲线下降的原因是
图中曲线下降的原因是②若气体流速过大,
 的转化率会降低,原因是
的转化率会降低,原因是(4)向恒温恒压的两个密闭容器甲
 、乙
、乙 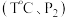 中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应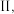 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 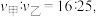 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为
您最近一年使用:0次
名校
解题方法
2 . 为测定 溶液的浓度,进行如下实验:用标准稀盐酸溶液进行滴定。
溶液的浓度,进行如下实验:用标准稀盐酸溶液进行滴定。
(1)配制
 盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要______ 。
(2)用______ 量取 待测
待测 溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取
溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取 溶液体积均为
溶液体积均为 ,三次实验结果如下:
,三次实验结果如下:
该 溶液的浓度约为
溶液的浓度约为______ 。
(3)滴定时边滴边摇动锥形瓶,眼睛______ 。判断到达滴定终点的实验现象是:滴加最后半滴标准液,溶液由______ ,且半分钟内不变色。
(4)下列操作会造成测定结果(待测 溶液浓度值)偏低的有
溶液浓度值)偏低的有______ 。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用标准稀盐酸溶液润洗
D.滴定到达终点时,俯视读出滴定管读数
E.摇动锥形瓶时有少量液体溅出瓶外
(5)中和滴定的装置和相似操作可用来做其它实验,如据反应 ,可以用碘水滴定
,可以用碘水滴定 溶液,应选
溶液,应选______ 作指示剂;据反应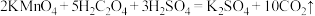
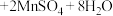 可以用酸性
可以用酸性 溶液滴定
溶液滴定 溶液,
溶液, 溶液应装在
溶液应装在______ 滴定管中(填写“酸式”或者“碱式”)。
 溶液的浓度,进行如下实验:用标准稀盐酸溶液进行滴定。
溶液的浓度,进行如下实验:用标准稀盐酸溶液进行滴定。(1)配制

 盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要(2)用
 待测
待测 溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取
溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取 溶液体积均为
溶液体积均为 ,三次实验结果如下:
,三次实验结果如下:| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗盐酸溶液体积 | 19.00 | 23.00 | 23.04 |
 溶液的浓度约为
溶液的浓度约为(3)滴定时边滴边摇动锥形瓶,眼睛
(4)下列操作会造成测定结果(待测
 溶液浓度值)偏低的有
溶液浓度值)偏低的有A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用标准稀盐酸溶液润洗
D.滴定到达终点时,俯视读出滴定管读数
E.摇动锥形瓶时有少量液体溅出瓶外
(5)中和滴定的装置和相似操作可用来做其它实验,如据反应
 ,可以用碘水滴定
,可以用碘水滴定 溶液,应选
溶液,应选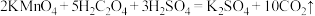
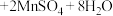 可以用酸性
可以用酸性 溶液滴定
溶液滴定 溶液,
溶液, 溶液应装在
溶液应装在
您最近一年使用:0次
名校
解题方法
3 . 甲醛有毒,被世界卫生组织列为一类致癌物。但甲醛是重要的工业原料,在化工、纺织、医疗等领域有广泛应用。
I.回收利用CO2是一种减弱温室效应的有效途径。科学家研究发现可利用回收的CO2与H2反应制备甲醛。
已知:①甲醛的燃烧热为akJ/mol;②H2燃烧热为bkJ/mol;③H2O(g)=H2O(l) ∆H2=-ckJ/mol
(1)CO2和H2合成甲醛的反应为CO2(g)+2H2(g)=HCHO(g)+H2O(g) ∆H=_____ 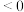
(2)在2L密闭容器中通入0.2molCO2和0.2molH2,在三种不同条件下发生(1)中反应,测得CO2的转化率与时间的关系如图1所示。_____ ;②由曲线Z到曲线X采取的措施可能是_____ 。
Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。_____ ,原因可能是_____ 。
(4)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图3所示,则a电极反应式为_____ 。国家标准是室内甲醛不能超过0.08mg·m-3,传感器在20m3室内空间测定,电路中有8×10-6mol电子通过,该室内甲醛含量为_____ mg·m-3。
I.回收利用CO2是一种减弱温室效应的有效途径。科学家研究发现可利用回收的CO2与H2反应制备甲醛。
已知:①甲醛的燃烧热为akJ/mol;②H2燃烧热为bkJ/mol;③H2O(g)=H2O(l) ∆H2=-ckJ/mol
(1)CO2和H2合成甲醛的反应为CO2(g)+2H2(g)=HCHO(g)+H2O(g) ∆H=
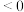
(2)在2L密闭容器中通入0.2molCO2和0.2molH2,在三种不同条件下发生(1)中反应,测得CO2的转化率与时间的关系如图1所示。
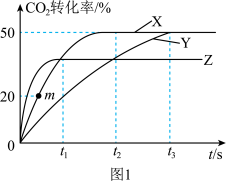
Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。
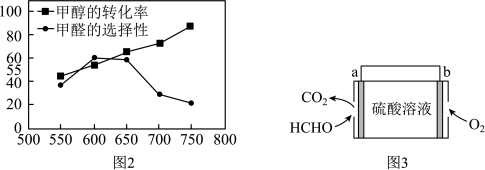
(4)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图3所示,则a电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g) 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 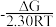 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
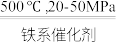 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
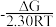 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近一年使用:0次
名校
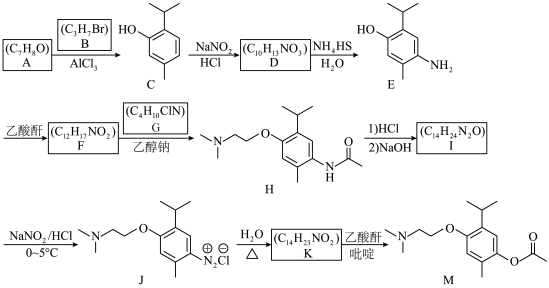
5 . 有机物M是一种用于治疗脑血管意外后遗症的药物。下列路线可用于合成该有机物,回答下列问题。 (乙酸酐)
(乙酸酐)
(1)B的化学名称为___________ 。
(2)I的结构简式为___________ ;F→H的反应类型为___________ 。
(3)F中含氧官能团的名称为___________ 。
(4)K→M的化学方程式为___________ 。
(5)符合下列条件D的同分异构体有___________ 种(不考虑立体异构)。
①属于芳香族化合物;②含有硝基;③含有手性碳原子。
(6)参照上述信息,写出以苯酚、1—溴丙烷为原料合成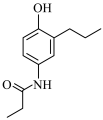 的路线
的路线_____ 。
 (乙酸酐)
(乙酸酐)(1)B的化学名称为
(2)I的结构简式为
(3)F中含氧官能团的名称为
(4)K→M的化学方程式为
(5)符合下列条件D的同分异构体有
①属于芳香族化合物;②含有硝基;③含有手性碳原子。
(6)参照上述信息,写出以苯酚、1—溴丙烷为原料合成
 的路线
的路线
您最近一年使用:0次
2024-02-02更新
|
459次组卷
|
5卷引用:山东省青岛市第一中学2023-2024学年高二下学期期中考试化学试卷
解题方法
6 . 在一定量铁的氧化物 (铁只有
(铁只有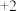 、
、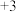 价)中,加入
价)中,加入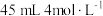 硫酸溶液,恰好使固体完全溶解,所得溶液中
硫酸溶液,恰好使固体完全溶解,所得溶液中 恰好被标准状况下
恰好被标准状况下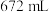 氯气氧化,则该固体中x和y的个数之比为
氯气氧化,则该固体中x和y的个数之比为
 (铁只有
(铁只有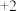 、
、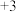 价)中,加入
价)中,加入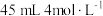 硫酸溶液,恰好使固体完全溶解,所得溶液中
硫酸溶液,恰好使固体完全溶解,所得溶液中 恰好被标准状况下
恰好被标准状况下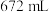 氯气氧化,则该固体中x和y的个数之比为
氯气氧化,则该固体中x和y的个数之比为A.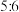 | B.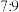 | C.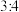 | D. |
您最近一年使用:0次
名校
7 . 硫酸工业在国民经济中占有极其重要的地位。如图是工业制硫酸的生产流程示意图,读图后回答下列小题。
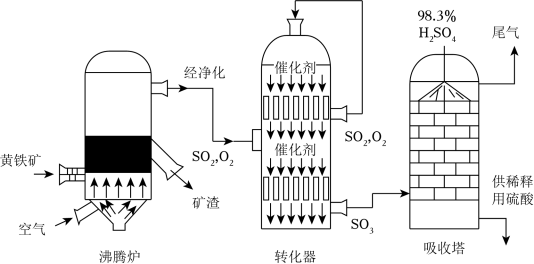
(1)转化是工业制硫酸的重要一步,即SO2和空气的混合物通过转化器反应生成SO3,实际生产中,反应温度选定在475℃左右。
①写出转化器中发生反应的化学方程式是_________ 。
②反应温度选在475℃左右的依据是________ 。
(2)依据工艺流程图判断下列说法错误的是_______。
(3)下列关于可逆反应的说法中,错误的是________。
(4)下列关于化学反应速率理论和化学平衡理论的说法正确的是_______。
(5)硫酸工业和合成氨工业的条件中的不同点是_______。
(6)下列叙述中不能用平衡移动原理解释的_______。
(7)氯水中加入AgNO3溶液后颜色会变浅。请结合方程式用平衡移动原理加以说明_____ 。
(8)我国二氧化硫排放标准限值为100mg•m﹣3,硫酸工业废气(假设含硫化合物均为SO2)可采用雾化的氨水与SO2直接接触吸收生成NH4HSO3.若烟气SO2含量为amg•m﹣3(a>100)试计算每立方米烟气至少需要浓度为bmol•L﹣1氨水______ L(用含a、b的代数式表示)。

(1)转化是工业制硫酸的重要一步,即SO2和空气的混合物通过转化器反应生成SO3,实际生产中,反应温度选定在475℃左右。
①写出转化器中发生反应的化学方程式是
②反应温度选在475℃左右的依据是
(2)依据工艺流程图判断下列说法错误的是_______。
| A.使用98.3%的硫酸来吸收三氧化硫是为了防止形成酸雾,影响吸收速率 |
| B.热交换器的使用不仅降低能耗,还能提高化工生产效率 |
| C.使用催化剂能提高SO2的反应速率和转化率 |
| D.沸腾炉排出的矿渣含铁量高,可直接作为炼铁的原料 |
| A.只要一种反应物足够多,另一种反应物的转化率就能达到100% |
| B.可逆反应的特点之一就是反应物和生成物共存 |
| C.化学平衡状态就是可逆反应在该条件下所能进行的最大限度 |
| D.可逆反应达到化学平衡的标志之一就是同一物质表示的正逆反应速率相等 |
| A.影响化学反应速率的因素只有浓度、压强、温度和催化剂 |
| B.凡是影响反应速率的因素均能使化学平衡发生移动 |
| C.凡是能使化学平衡发生移动的因素均会影响反应速率 |
| D.加快反应速率有利于平衡正向移动 |
| A.均使用热交换器 | B.均使用催化剂 |
| C.高温 | D.高压 |
| A.向某浓度的FcCl3溶液中滴加少量KSCN溶液,再滴入NaOH溶液后红色变浅 |
B.密闭容器中发生如下反应:H2(g)+I2(g) 2HI(g),拉伸容器混合气颜色变浅 2HI(g),拉伸容器混合气颜色变浅 |
| C.工业制硫酸过程中通入过量空气能提高硫酸产率 |
| D.合成氨生产中要不断补充新鲜的高压氮、氢混合气 |
(8)我国二氧化硫排放标准限值为100mg•m﹣3,硫酸工业废气(假设含硫化合物均为SO2)可采用雾化的氨水与SO2直接接触吸收生成NH4HSO3.若烟气SO2含量为amg•m﹣3(a>100)试计算每立方米烟气至少需要浓度为bmol•L﹣1氨水
您最近一年使用:0次
名校
8 . 神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。相关物质的摩尔生成焓∆HfHm如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用∆HfHm表示。如N2H4(1)的摩尔生成焓:N2(g)+2H2(g)=N2H4(l) ∆HfHm =+165.8kJ/mol
①∆H1=___________ kJ/mol。
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是___________ 。
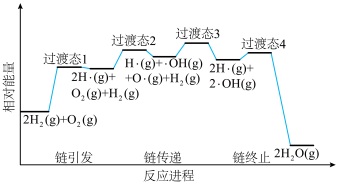
(2)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。___________ 步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1=+247 kJ/mol
b:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41kJ/mol
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力pΦ(pΦ=100kPa)。反应a、b的ln随 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。___________ ,反应a的标准压强平衡常数表达式 =
=___________ 。
②维持T1温度下,往恒容密闭容器中通入等量CH4、CO2、H2O混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下CH4的平衡转化率为___________ ,H2的平衡分压为___________ (结果保留3位有效数字)kPa。
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
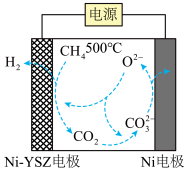
(4)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:___________ 。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。相关物质的摩尔生成焓∆HfHm如下表所示。
| 物质 | N2O4(g) | N2H4(l) | H2O(g) |
| 摩尔生成焓∆HfHm(kJ/mol) | +10.8 | +165.8. | -242.0 |
①∆H1=
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是
(2)火箭推进器内氨氧燃烧的简化反应历程如下图所示,分析其反应机理。
Ⅱ.利用“一碳化学”技术可有效实现工业制氢,为推进剂提供了丰富的氢燃料,该工业制氢方法主要涉及以下两个反应:
a:CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1=+247 kJ/mol
b:CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41kJ/mol
已知为反应的标准压强平衡常数,其表达方法为:在浓度平衡常数表达式中,用各组分气体平衡时的相对分压代替浓度;气体的相对分压等于其分压(单位为kPa)除以标准压力pΦ(pΦ=100kPa)。反应a、b的ln随
 (T为温度)的变化如图所示。
(T为温度)的变化如图所示。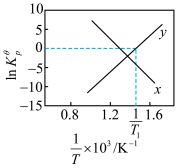
 =
=②维持T1温度下,往恒容密闭容器中通入等量CH4、CO2、H2O混合气体发生反应a、b,初始压强为120kPa,达平衡时体系压强为140kPa.该温度下CH4的平衡转化率为
Ⅲ.电解法在物质制备中具有巨大的研究价值,可广泛用于化工生产。
(4)我国科学家报道了一种在500℃下电解甲烷制氢的方法,反应原理如下图所示,请写出Ni电极上的电极反应式:
您最近一年使用:0次
2024-01-03更新
|
509次组卷
|
5卷引用:湖南省永州市道县第一中学2023-2024学年高三下学期5月期中考试化学试题
(已下线)湖南省永州市道县第一中学2023-2024学年高三下学期5月期中考试化学试题河北省石家庄市第四十三中学2023-2024学年高三上学期12月月考化学试题湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题湖南省长沙市第一中学2024届高三下学期三模化学试题(已下线)T17-原理综合题
名校
解题方法
9 . 钴(27Co)元素容易形成配合物,其常见+2、+3价。
(1)已知配合物的磁矩μB= BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈
BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈ BM,则该离子所带电荷数目及符号为
BM,则该离子所带电荷数目及符号为 ___________ 。
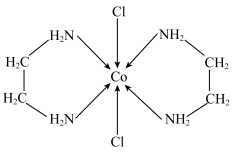
(2)中子衍射实验证实,晶体[Co(NH2CH2CH2NH2)2Cl2]Cl·HCl·2H2O中仅存在3种离子(不存在分子):Cl﹣、X+和上述含钴配离子。该晶体中存在的化学键类型有___________ ;含钴配离子中提供孤电子对的原子是 ___________ ,配位数是 ___________ ;X+是 ___________ (填离子符号)。
(3)乙二胺(NH2CH2CH2NH2)与正丁烷(CH3CH2CH2CH3)的相对分子质量相近,乙二胺沸点比正丁烷高的原因是___________ 。
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子)。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是___________ (填字母)。
a.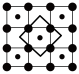 b.
b. 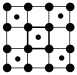 c.
c. 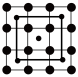 d.
d. 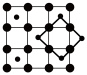
(5)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出[Co(CN)6]4-转变成[Co(CN)6]3-反应的离子方程式:___________ (提示:该反应在碱性条件下进行)
(1)已知配合物的磁矩μB=
 BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈
BM(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,NH2CH2CH2NH2为电中性配体],若测得其μB≈ BM,则该离子所带电荷数目及符号为
BM,则该离子所带电荷数目及符号为 
(2)中子衍射实验证实,晶体[Co(NH2CH2CH2NH2)2Cl2]Cl·HCl·2H2O中仅存在3种离子(不存在分子):Cl﹣、X+和上述含钴配离子。该晶体中存在的化学键类型有
(3)乙二胺(NH2CH2CH2NH2)与正丁烷(CH3CH2CH2CH3)的相对分子质量相近,乙二胺沸点比正丁烷高的原因是
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子)。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是
a.
 b.
b.  c.
c.  d.
d. 
(5)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出[Co(CN)6]4-转变成[Co(CN)6]3-反应的离子方程式:
您最近一年使用:0次
名校
10 . 有机增塑剂 和
和 的质子数均为32,其相对分子质量相差5;X、W、R三种元素同周期,X原子的最外层电子数为R电子总数的一半。下列说法正确的是
的质子数均为32,其相对分子质量相差5;X、W、R三种元素同周期,X原子的最外层电子数为R电子总数的一半。下列说法正确的是
 和
和 的质子数均为32,其相对分子质量相差5;X、W、R三种元素同周期,X原子的最外层电子数为R电子总数的一半。下列说法正确的是
的质子数均为32,其相对分子质量相差5;X、W、R三种元素同周期,X原子的最外层电子数为R电子总数的一半。下列说法正确的是| A.Y、Z互为同素异形体 | B.元素的第一电离能:W>R |
| C.原子半径:R>X | D.常温常压下,X、W的单质为固体 |
您最近一年使用:0次
2023-12-16更新
|
674次组卷
|
2卷引用:浙江省宁波市镇海中2023-2024学年高二下学期期中考试化学试题



