名校
解题方法
1 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数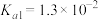 ,
,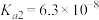 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数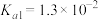 ,
,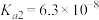 。下列说法正确的是
。下列说法正确的是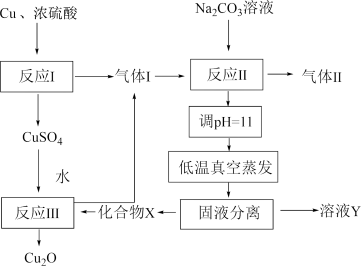
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比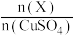 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
2024-06-10更新
|
103次组卷
|
4卷引用:湖南师大附中2023-2024学年高二下学期期中考试化学试题
2 . 醋酸是常见的一元弱酸。请运用化学反应原理回答下列问题:
(1)室温下,pH=2的醋酸中,水电离出的c(H+)=___________ mol·L-1该醋酸和pH=2的盐酸溶液相比,导电性___________ (填“相同”“不同”或“无法判断”)。
(2)pH相同的盐酸和醋酸分别与足量的锌粒反应,生成等量的H2时所需时间较短的是___________ 。
(3)向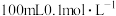 醋酸溶液中滴入
醋酸溶液中滴入 溶液,下列浓度大小顺序不可能出现的是
溶液,下列浓度大小顺序不可能出现的是___________ (填字母)。
a.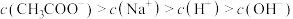
b.
c.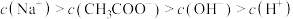
d.
(4)常温下,将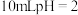 的醋酸溶液稀释至
的醋酸溶液稀释至 ,溶液的
,溶液的
___________ (填“>”“<”或“=”)4;在醋酸稀释过程中下列数值变大的是___________ 。
A. B.
B. C.
C. D.
D.
(5)醋酸中存在平衡: ,下列措施可使醋酸的
,下列措施可使醋酸的 增大,并且电离平衡向右移动的是___________。
增大,并且电离平衡向右移动的是___________。
(1)室温下,pH=2的醋酸中,水电离出的c(H+)=
(2)pH相同的盐酸和醋酸分别与足量的锌粒反应,生成等量的H2时所需时间较短的是
(3)向
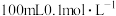 醋酸溶液中滴入
醋酸溶液中滴入 溶液,下列浓度大小顺序不可能出现的是
溶液,下列浓度大小顺序不可能出现的是a.
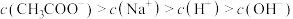
b.

c.
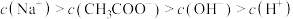
d.

(4)常温下,将
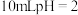 的醋酸溶液稀释至
的醋酸溶液稀释至 ,溶液的
,溶液的
A.
 B.
B. C.
C. D.
D.
(5)醋酸中存在平衡:
 ,下列措施可使醋酸的
,下列措施可使醋酸的 增大,并且电离平衡向右移动的是___________。
增大,并且电离平衡向右移动的是___________。A.加入 溶液 溶液 | B.加入盐酸 | C.加水稀释 | D.对醋酸溶液加热 |
您最近一年使用:0次
名校
3 . 微生物脱盐池的a极上加入了呼吸细菌,工作时可将工业废水中的有机污染物转化为 ,其工作原理如图所示。下列说法正确的是
,其工作原理如图所示。下列说法正确的是
 ,其工作原理如图所示。下列说法正确的是
,其工作原理如图所示。下列说法正确的是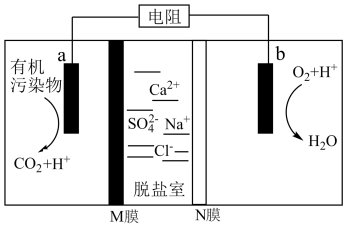
A.工作时, 极发生还原反应,电子从 极发生还原反应,电子从 极流向 极流向 极 极 |
B. 膜为阴离子交换膜,脱盐室最终可得到淡盐水 膜为阴离子交换膜,脱盐室最终可得到淡盐水 |
C. 极上消耗 极上消耗 气体,则通过 气体,则通过 膜的离子的物质的量为 膜的离子的物质的量为 |
D.若有机物的分子式为 ,则 ,则 极的电极反应式为 极的电极反应式为 |
您最近一年使用:0次
2024-05-06更新
|
385次组卷
|
2卷引用:山东省潍坊一中2023-2024学年高一下学期期中模拟检测化学试题
4 . 请回答下列问题:
(1) 可发生二聚反应生成
可发生二聚反应生成  ,化学方程式为
,化学方程式为 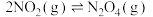 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
___________ 0(填“>”或“<”)。已知该反应的正反应速率方程为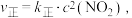 逆反应速率方程为
逆反应速率方程为 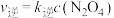 ,其中
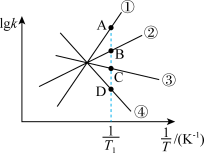
,其中 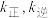 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 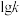 表示速率常数的对数;
表示速率常数的对数; 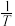 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 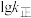 随
随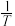 变化关系的是斜线
变化关系的是斜线___________ ,能表示 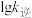 随
随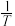 变化关系的是斜线
变化关系的是斜线___________ 。
(2)图中 点的纵坐标分别为
点的纵坐标分别为 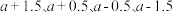 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K=___________ mol/L。已知温度  时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 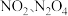 浓度均为
浓度均为 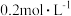 ,此时v正
,此时v正___________ v逆(填“>”“<”或“=”)。
(1)
 可发生二聚反应生成
可发生二聚反应生成  ,化学方程式为
,化学方程式为 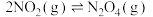 ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
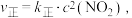 逆反应速率方程为
逆反应速率方程为 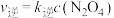 ,其中
,其中 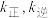 分别为正、逆反应的速率常数。则如图(
分别为正、逆反应的速率常数。则如图( 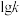 表示速率常数的对数;
表示速率常数的对数; 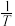 示温度的倒数)所示①、②、③、④四条斜线中,能表示
示温度的倒数)所示①、②、③、④四条斜线中,能表示 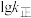 随
随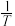 变化关系的是斜线
变化关系的是斜线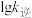 随
随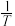 变化关系的是斜线
变化关系的是斜线
(2)图中
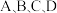 点的纵坐标分别为
点的纵坐标分别为 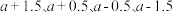 ,则温度
,则温度  时化学平衡常数K=
时化学平衡常数K= 时,某时刻恒容密闭容器中
时,某时刻恒容密闭容器中 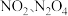 浓度均为
浓度均为 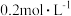 ,此时v正
,此时v正
您最近一年使用:0次
解题方法
5 .  等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
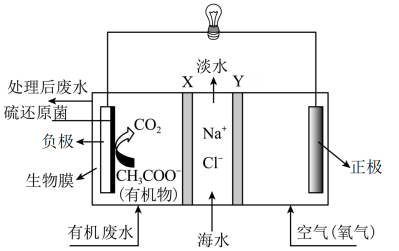
 等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是
| A.该装置可以在高温下工作 |
B. 依次为阴离子、阳离子交换膜 依次为阴离子、阳离子交换膜 |
C.负极反应式为 |
| D.该装置工作时,电能转化为化学能 |
您最近一年使用:0次
名校
解题方法
6 . 以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:
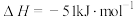
反应Ⅱ:
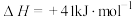
①已知几种化学键的键能如下表所示,则a=_____ kJ·mol-1.
②若反应Ⅱ逆反应活化能 ,则该反应的正反应的活化能
,则该反应的正反应的活化能
_____ kJ·mol-1.
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数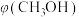 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中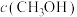 关系如图2所示:
关系如图2所示:
①图1中P1_____ P2(填“>”、“<”或“=”);
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是_____ (填字母序号)。 、
、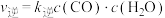 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是_____ ,表示lgk逆随温度T变化关系的直线是_____ 。
(4)已知一定温度下按照起始比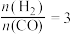 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
_____ MPa-2(保留2位有效数字)(各气体分压=平衡体系中各气体的体积分数×总压)。
(5)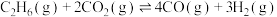
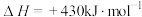 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:

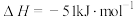
反应Ⅱ:

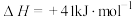
①已知几种化学键的键能如下表所示,则a=
| 化学键 | C—H | C—O | H—O | H—H | C≡O |
| 键能/kJ·mol-1 | 406 | 351 | 465 | 436 | a |
 ,则该反应的正反应的活化能
,则该反应的正反应的活化能
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数
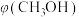 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中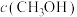 关系如图2所示:
关系如图2所示:①图1中P1
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是

 、
、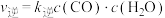 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是(4)已知一定温度下按照起始比
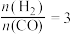 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
(5)
 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。| A.恒温恒容容器 | B.恒容绝热容器 |
| C.恒压绝热容器 | D.恒温恒压容器 |
您最近一年使用:0次
名校
7 . 常温下,分别取未知浓度的 和
和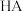 溶液,加水稀释至原体积的
溶液,加水稀释至原体积的 倍,稀释过程中,两溶液
倍,稀释过程中,两溶液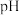 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

 和
和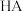 溶液,加水稀释至原体积的
溶液,加水稀释至原体积的 倍,稀释过程中,两溶液
倍,稀释过程中,两溶液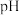 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
A. 为弱碱, 为弱碱,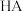 为强酸 为强酸 |
| B.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性 |
C.若升高温度,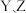 点对应溶液的 点对应溶液的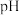 均不变 均不变 |
D.水的电离程度: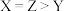 |
您最近一年使用:0次
2024-04-08更新
|
53次组卷
|
2卷引用:山东省济南市历城第一中学2023-2024学年高二上学期期中考试化学试题
解题方法
8 . 有200mlMgCl2和AlCl3的混合物,其中c(Mg2+)为0.2mol/L,c(C1-)为1.3mol/L。为使Mg2+全部转化为沉淀分离出来,至少需加4mol/L溶液的NaOH体积为
| A.40ml | B.72ml | C.80ml | D.128ml |
您最近一年使用:0次
2024-04-08更新
|
96次组卷
|
6卷引用:2015-2016学年江苏省海安实验中学高二上学期期中必修化学试卷
2015-2016学年江苏省海安实验中学高二上学期期中必修化学试卷浙江省湖州市长兴县等三县2017-2018学年高二上学期期中考试化学试题江西省余干县第二中学2020-2021学年高一上学期12月月考化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题云南省大理白族自治州实验中学2020-2021学年高一上学期(理科)期末考试化学试题(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
9 . 室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应。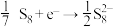 ,
, ,
, ,下列叙述错误的是
,下列叙述错误的是
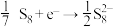 ,
, ,
, ,下列叙述错误的是
,下列叙述错误的是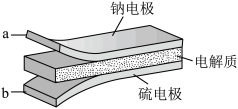
A.放电时 从硫电极向钠电极迁移 从硫电极向钠电极迁移 |
| B.放电时外电路电子流动的方向是a→b |
C.放电时正极反应为: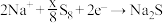 |
| D.炭化纤维素纸的作用是增强硫电极导电性能 |
您最近一年使用:0次
2024-04-07更新
|
93次组卷
|
4卷引用:浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷
名校
解题方法
10 . 将1.76g镁铜合金投入20mL一定浓度的硝酸中,合金完全溶解,产生NO和NO2混合气体896mL(不考虑其他气体,体积折算为标准状况下),反应结束后向溶液中加入120mL1mol·L-1NaOH溶液,恰好使溶液中的金属阳离子全部转化为沉淀3.12g。若将盛有896mL该混合气体的容器倒扣在水中,通入一定体积的氧气,恰好可将该混合气体完全转化。下列说法错误的是
| A.Mg与Cu的物质的量比值为3:1 | B.NO和NO2的体积比为1:1 |
| C.原硝酸的浓度为8mol·L-1 | D.通入的O2的体积(标准状况下)V=448mL |
您最近一年使用:0次
2024-04-06更新
|
398次组卷
|
4卷引用:安徽省淮南二中2023-2024学年高一下学期期中教学检测化学试题
安徽省淮南二中2023-2024学年高一下学期期中教学检测化学试题湖南省常德市沅澧共同体2023-2024学年高一下学期期中考试化学试题安徽省淮北市第一中学2023-2024学年高一下学期3月月考化学试题(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)



