13-14高三·全国·课时练习
1 . 用下图所示装置进行实验,下表中实验结果能说明结论的是
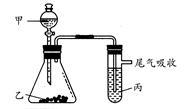

| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:水>C2H2>Br2 |
| B | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| C | 盐酸 | FeS | 溴水 | 还原性:S2->Br->Cl- |
| D | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4<Cl2<Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如右图所示(夹持仪器已略去)。
(1)实验前,应先检查装置的___ ;实验中产生的尾气应通入___ 溶液进行处理。
(2)实验过程中需要配制100 mL l mol·L-1FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、___ ;实际配制过程中,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,此特殊操作的目的是____ 。
(3)该小组同学向5 mL l mol·L-1FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式___ 。再打开分液漏斗活塞,逐滴加入煮沸冷却后的NaOH稀溶液,则试管B中产生的实验现象是___ 。
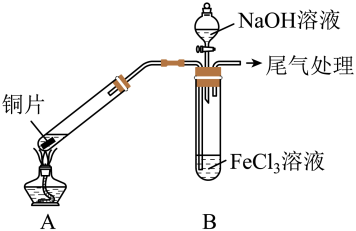
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】[Fe(HSO3)]2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为 。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是
。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是___ 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mol·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为____ 。(忽略过程中溶液的体积变化)
(1)实验前,应先检查装置的
(2)实验过程中需要配制100 mL l mol·L-1FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、
(3)该小组同学向5 mL l mol·L-1FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式

(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】[Fe(HSO3)]2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为
 。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是
。则[Fe(HSO3)]2+与Fe3+在溶液中反应的离子方程式是(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mol·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为
您最近一年使用:0次
2016-12-09更新
|
604次组卷
|
2卷引用:湖南省长沙市第一中学2018届高三上学期晚自习测试(一)化学试题
真题
解题方法
3 . 食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性: >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I﹣,3I2+6OH﹣=
>I﹣,3I2+6OH﹣= +5I﹣+3H2O;KI+I2⇌KI3
+5I﹣+3H2O;KI+I2⇌KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是____ (用化学式表示);CCl4中显紫红色的物质是_____ (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_____ 、_____ 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:_____ 。将I2溶于KI溶液,在低温条件下,可制得KI3•H2O。该物质作为食盐加碘剂是否合适?_____ (填“是”或“否”),并说明理由_______ 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_____ 。
A.Na2S2O3B.AlCl3C.Na2CO3D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+。_____ 。
 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I﹣,3I2+6OH﹣=
>I﹣,3I2+6OH﹣= +5I﹣+3H2O;KI+I2⇌KI3
+5I﹣+3H2O;KI+I2⇌KI3(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是
②第二份试液中加入足量KI固体后,反应的离子方程式为
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是
A.Na2S2O3B.AlCl3C.Na2CO3D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+。
您最近一年使用:0次
2019-01-30更新
|
1509次组卷
|
5卷引用:2014年化学高考总复习课时演练 11-4化学实验方案设计与评价练习卷
(已下线)2014年化学高考总复习课时演练 11-4化学实验方案设计与评价练习卷(已下线)2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷2011年普通高等学校招生全国统一考试化学卷(浙江)(已下线)2015届河南省顶级名校高三入学定位考试化学试卷2017届河北省邯郸市大名一中高三上学期第一次月考化学试卷
2011·新疆·三模
4 . CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是
| A.Cs显+3价,I 、Cl 均显-1价 |
| B.Cs显 +1价,Cl显+1价,I显-1价、 |
| C.在CsICl2溶液中通入Cl2 ,有单质碘生成 |
| D.在CsICl2溶液中通入SO2气体,有硫酸生成 |
您最近一年使用:0次
13-14高三·全国·课时练习
解题方法
5 . 关于化合物xNa2CO3·yH2O2的推理不正确的是
| A.若1mol该化合物受热完全分解后余下固体212g,则x =" y" =3 |
| B.若向其滴加稀硫酸有无色气体生成,则该气体可能含有O2和CO2 |
| C.若向其新制溶液中滴加酸性高锰酸钾溶液后褪色,则其溶液具有还原性 |
| D.若向其新制溶液中滴加酚酞后溶液先变红后褪色,则其溶液具有碱性和漂白性 |
您最近一年使用:0次
6 . 下列关于物质的分类、性质、用途说法全部正确的是
| A.水玻璃—混合物 氨水—弱碱 |
| B.油脂—天然高分子化合物 有机玻璃—合成高分子化合物 |
| C.二氧化硅—半导体材料 硅单质—光纤材料 |
| D.高锰酸钾溶液—氧化性 碳酸钠溶液—碱性 |
您最近一年使用:0次
名校
解题方法
7 . 亚氯酸盐(如NaClO2等)可用作漂白剂,在常温避光条件下可保存一年,但在酸性条件下能生成亚氯酸,亚氯酸进而发生分解:5HClO2=4ClO2↑+H++Cl-+2H2O。若在发生分解时加入稀硫酸,发现开始时反应缓慢,然后反应突然加快,并释放出大量ClO2,产生这种现象的原因是( )
| A.酸使亚氯酸的氧化性增强 | B.溶液中的H+起催化作用 |
| C.溶液中的Cl-起催化作用 | D.逸出的ClO2使生成物的浓度降低 |
您最近一年使用:0次
2020-10-11更新
|
511次组卷
|
18卷引用:辽宁省大连育明高级中学2018届高三人教版选修四9.7同步测试化学试题
辽宁省大连育明高级中学2018届高三人教版选修四9.7同步测试化学试题高二人教版选修4 第二章 第二节 影响化学反应速率的因素鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 浓度、温度、催化剂对化学反应速率的影响第一节 化学反应速率 第2课时 影响化学反应速率的因素 活化能第2课时 影响化学反应速率的因素四川省南充高级中学2016-2017学年高一下学期期末考试化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考【全国百强校】河北省武邑中学2018-2019学年高二上学期第二次月考化学试题云南省玉溪市通海二中2018-2019学年高一5月份考试化学试题(已下线)2019年6月25日《每日一题》必修2—— 押题2 燃料电池分析2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷浙江省宁波市北仑中学2019-2020学年高二下学期期中考试化学(选考)试题内蒙古赤峰二中2019-2020学年高一下学期第二次月考(6月)化学试题陕西省西安市第一中学2020-2021学年高二上学期期中考试化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题云南省腾冲市第一中学2021-2022学年高二下学期3月份考试化学试题河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题
13-14高三·全国·课时练习
名校
8 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是_______ 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_______ 。
(3)根据上述反应可推知_________ 。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的计量数填入下列方框中,并标出电子转移的方向和数目。

______________
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为
(3)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的计量数填入下列方框中,并标出电子转移的方向和数目。

您最近一年使用:0次
2014-04-11更新
|
391次组卷
|
6卷引用:2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷
(已下线)2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(已下线)2014-2015学年辽宁省沈阳二中高一上学期期中化学试卷2014-2015江苏省南通中学高二上学期期末化学(理)试卷2015-2016学年河北冀州市中学高一上第四次月考化学试卷陕西省西安市长安区第一中学2017-2018学年高一上学期期中考试化学试题(已下线)上海市行知中学2014-2015学年高二上学期期中考试化学试题
10-11高三上·黑龙江·期末
名校
9 . 用下列两种途径制取H2SO4,某些反应条件和产物已省略,下列有关说法不正确的是( )
途径① S H2SO4
H2SO4
途径② S SO2
SO2 SO3
SO3 H2SO4
H2SO4
途径① S
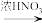 H2SO4
H2SO4途径② S
 SO2
SO2 SO3
SO3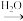 H2SO4
H2SO4| A.途径①反应中体现了浓HNO3的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2的浓度来降低成本 |
| C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol电子 |
| D.途径②与途径①相比较更能体现“绿色化学”的理念,因为途径②比途径①的污染相对较小且原子利用率较高 |
您最近一年使用:0次
2018-12-15更新
|
200次组卷
|
12卷引用:2014年化学高考总复习课时演练 11-3物质的制备练习卷
(已下线)2014年化学高考总复习课时演练 11-3物质的制备练习卷(已下线)2011届黑龙江省哈九中高三上学期期末考试化学试卷(已下线)2013届福建省四地六校高三第三次月考化学试卷2016届吉林省东北师大附属中学高三上第二次模拟化学试卷(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (题型专练)全国名校大联考2018届高三上学期第二次联考化学试题内蒙古第一机械制造(集团)有限公司第一中学2020届高三上学期第一次月考化学试题新人教版必修2同步测试:5.1.3不同价态含硫物质的转化(已下线)【南昌新东方】2018-2019 莲塘一中 高三9月 013黑龙江省牡丹江市第二高级中学2023-2024学年高三上学期第三次阶段性考试化学试题2015-2016学年云南省曲靖一中高一下期中化学试卷2015-2016学年河北保定一中高二下期末化学试卷
13-14高三·全国·课时练习
解题方法
10 . 下列有关元素及其化合物知识的说法中正确的是
| A.浓硝酸能与木炭反应,证明浓硝酸既具有强氧化性又具有强酸性 |
| B.溴中溶有少量氯气,可用先加入少量溴化钠溶液再用酒精萃取的方法提纯 |
| C.高温下SiO2与Na2CO3反应生成Na2SiO3和CO2,证明硅酸酸性强于碳酸 |
| D.铵盐受热都能分解,但不一定都能生成氨气 |
您最近一年使用:0次



