解题方法
1 . 用A合成G的路线如下图所示。请回答相关问题。
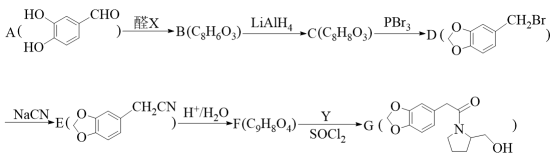
已知:I.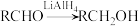
II.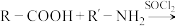
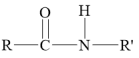 +H2O
+H2O
III.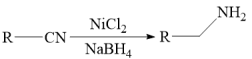
(1)醛X的名称是_______ ,D中的官能团有_______ 。
(2)C的结构简式是_______ ,C到D的反应类型是_______ 。
(3)请写出F到G的化学方程式_______ 。
(4)E的同分异构体中,满足下列条件的同分异构体(不考虑立体异构)一共有_______ 种,其中,有4种不同化学环境的H,且个数比为 的同分异构体的结构简式是
的同分异构体的结构简式是_______ 。
①属于芳香族化合物 ②含有官能团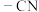 ③不可以和NaHCO3溶液反应放出气体
③不可以和NaHCO3溶液反应放出气体
(5)写出以苯甲醇(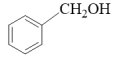 )为原料制备
)为原料制备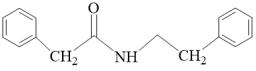 的合成路线(其他无机试剂任选):
的合成路线(其他无机试剂任选):_______ 。

已知:I.
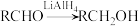
II.
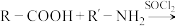
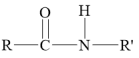 +H2O
+H2OIII.

(1)醛X的名称是
(2)C的结构简式是
(3)请写出F到G的化学方程式
(4)E的同分异构体中,满足下列条件的同分异构体(不考虑立体异构)一共有
 的同分异构体的结构简式是
的同分异构体的结构简式是①属于芳香族化合物 ②含有官能团
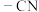 ③不可以和NaHCO3溶液反应放出气体
③不可以和NaHCO3溶液反应放出气体(5)写出以苯甲醇(
 )为原料制备
)为原料制备 的合成路线(其他无机试剂任选):
的合成路线(其他无机试剂任选):
您最近一年使用:0次
2 . 2005年2月23日国家质量监督检验疫总局发出紧急通知,要求各地质检部门加强对含有苏丹红一号食品的检验监管。有关食品安全方面的话题再度成为关注焦点。苏丹红一号属偶氮类化工染料,主要用于溶剂、蜡、汽油的增色和鞋、地板等的增光,人食用后,有较强的致癌性。制造偶氮染料的方法主要包括重氮化和偶合两个步骤。例如:
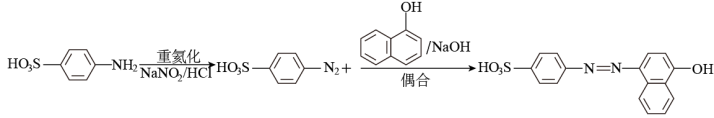
苏丹红一号的结构简式为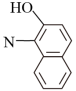 ,它以苯和萘为主要原料合成路线如下:
,它以苯和萘为主要原料合成路线如下:
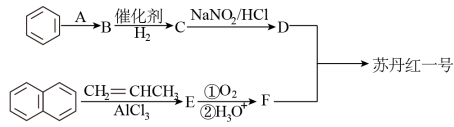
已知: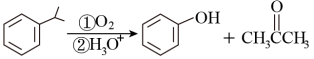
(1)写出试剂A和中间体B、C、D、E、F的结构简式:A_______ ,B_______ ,C_______ ,D_______ ,E_______ ,F_______ ;
(2)苯→B的反应类型是_______ ;B→C的反应类型是_______ 。

苏丹红一号的结构简式为
 ,它以苯和萘为主要原料合成路线如下:
,它以苯和萘为主要原料合成路线如下:
已知:

(1)写出试剂A和中间体B、C、D、E、F的结构简式:A
(2)苯→B的反应类型是
您最近一年使用:0次
3 . nesteretal A是一种从某菌体中提取出来的笼状聚半缩酮,在2021年,化学家Yuichiro Kawamoto等人提出了nesteretal A的一种全合成路线。下面展示了该全合成路线的部分反应。
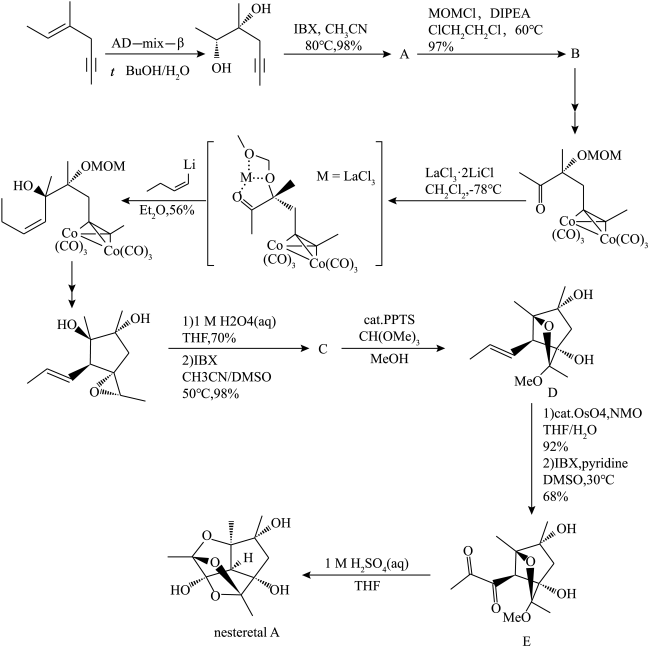
(1)已知IBX是一种氧化剂,可以将醇氧化为酮;环氧乙烷在酸性水溶液中会水解为乙二醇。请画出A、C的键线式______ 、______ 。
(2)根据前后反应,写出MOMCl的键线式______ ,并说明A到B的反应类型______ 。
(3)加入反应物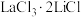 的目的是什么
的目的是什么______ ?
(4)试画出D到E的第一步反应产物的键线式______ 。(不要求立体构型)
(5)请写出nesteretal A的分子式_______ 。

(1)已知IBX是一种氧化剂,可以将醇氧化为酮;环氧乙烷在酸性水溶液中会水解为乙二醇。请画出A、C的键线式
(2)根据前后反应,写出MOMCl的键线式
(3)加入反应物
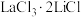 的目的是什么
的目的是什么(4)试画出D到E的第一步反应产物的键线式
(5)请写出nesteretal A的分子式
您最近一年使用:0次
4 . 简要回答下列问题。
(1)利用不同的催化剂,乙烯催化氧化可选择性地生成不同产物。产物A可使石灰水变浑浊。写出与A摩尔质量相等的其他所有产物的分子式和结构简式__________ 。
(2)化合物 呈抗磁性。每个
呈抗磁性。每个 周围有12个
周围有12个 离子,每个
离子,每个 离子周围有5个金属离子。金离子处在
离子周围有5个金属离子。金离子处在 离子围成的配位中心(也是对称中心)。写出该化合物中Au的氧化态及其对应的配位几何构型
离子围成的配位中心(也是对称中心)。写出该化合物中Au的氧化态及其对应的配位几何构型__________ 。
(3)2019年1月,嫦娥四号成功在月球着陆。探测器上的五星红旗有一类特殊的聚酰亚胺制成。以下是某种芳香族聚酰亚胺的合成路线。
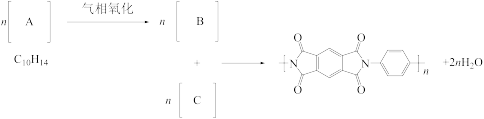
画出A、B、C的结构简式__________ 、__________ 、__________ 。
(1)利用不同的催化剂,乙烯催化氧化可选择性地生成不同产物。产物A可使石灰水变浑浊。写出与A摩尔质量相等的其他所有产物的分子式和结构简式
(2)化合物
 呈抗磁性。每个
呈抗磁性。每个 周围有12个
周围有12个 离子,每个
离子,每个 离子周围有5个金属离子。金离子处在
离子周围有5个金属离子。金离子处在 离子围成的配位中心(也是对称中心)。写出该化合物中Au的氧化态及其对应的配位几何构型
离子围成的配位中心(也是对称中心)。写出该化合物中Au的氧化态及其对应的配位几何构型(3)2019年1月,嫦娥四号成功在月球着陆。探测器上的五星红旗有一类特殊的聚酰亚胺制成。以下是某种芳香族聚酰亚胺的合成路线。
画出A、B、C的结构简式
您最近一年使用:0次
5 . 常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:

已知:

(1)A的核磁共振氢谱有两种峰,A的名称是_____________ ;
(2)A与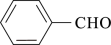 合成B的化学方程式是
合成B的化学方程式是_____________ ;
(3)C由B还原得到。C的结构简式是_________________ ;
(4)E能使Br2的CCl4溶液褪色,N由A经反应①~③合成。
a.①的化学试剂和条件是_______________ 。
b.②的反应类型是_____________ 。
c.③的化学方程式是_____________ ;
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是______________ ;
(6)碱性条件下,PVAc完全水解的化学方程式是___________________ 。

已知:

(1)A的核磁共振氢谱有两种峰,A的名称是
(2)A与
 合成B的化学方程式是
合成B的化学方程式是(3)C由B还原得到。C的结构简式是
(4)E能使Br2的CCl4溶液褪色,N由A经反应①~③合成。
a.①的化学试剂和条件是
b.②的反应类型是
c.③的化学方程式是
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是
(6)碱性条件下,PVAc完全水解的化学方程式是
您最近一年使用:0次
6 . 塑料的发明为现代生活提供了极大的便利,但同时带来了白色污染等诸多环境问题。为了解决可回收问题,研究人员尝试将各种动态共价键作为高分子的交联剂,致力于发展“绿色”的可循环高分子经济。例如,烷基取代的三嗪衍生物中的C-O键,可被作为“休眠”的共价键交联点用于制备完全可回收的热固性聚合物。反应物A在TBD(一种胺,可作为反应的催化剂)存在下与甲醇会发生反应:
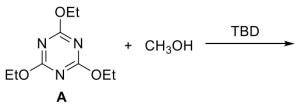
(1)通过气相色谱-质谱联用表征,检测得知反应混合物中有四个化合物,其m/z值分别为171.1,185.1,199.1和213.1。画出所得产物的结构___________ 。
(2)研究该反应的动力学,研究人员将反应物A与氘代甲醇在TBD存在下发生反应,其中氘代甲醇同时起到溶剂的作用,其密度为0.888g/mL。表征结果如图所示。确定该反应条件下的反应级数。计算至少2个温度下的反应速率常数并计算反应的活化能________ 。

(3)参照上述反应思路,研究人员设计了一种合成可回收的热固性聚合物的方法:

完成上述反应方程式___________ 。请提出一种可能的降解回收方式___________ 。

(1)通过气相色谱-质谱联用表征,检测得知反应混合物中有四个化合物,其m/z值分别为171.1,185.1,199.1和213.1。画出所得产物的结构
(2)研究该反应的动力学,研究人员将反应物A与氘代甲醇在TBD存在下发生反应,其中氘代甲醇同时起到溶剂的作用,其密度为0.888g/mL。表征结果如图所示。确定该反应条件下的反应级数。计算至少2个温度下的反应速率常数并计算反应的活化能

(3)参照上述反应思路,研究人员设计了一种合成可回收的热固性聚合物的方法:

完成上述反应方程式
您最近一年使用:0次
7 . 二氧化碳( )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,低碳烯烃 作为基础化工原料,是 加氢转化的主要产品之一、
加氢转化的主要产品之一、
请回答:
(1)以合成 为例,其合成反应为:
为例,其合成反应为:

①已知 的燃烧热为
的燃烧热为 ;
;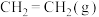 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
___________ (请用 、
、 、
、 表示)
表示)
②该反应在较低温度时能自发进行,可能原因为___________ 。
③在体积为V L的恒容密闭容器中,以 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为___________ , 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为___________ 。 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:
第一步: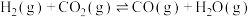

第二步: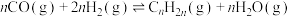

第二步的机理及可能的副反应如图: 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
①下列说法不正确的是___________ 。
A.第一步反应中,在催化剂表面, 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化
B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生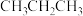 等副产品
等副产品
②在其他条件恒定的情况下,适当降低原料气的流速, 的转化率将
的转化率将___________ (填“增大”或“减小”),原因为___________ ;产物中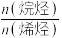 将
将___________ ,原因为___________ 。(结合反应机理中的步骤来回答)
 )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措, 加氢转化的主要产品之一、
加氢转化的主要产品之一、请回答:
(1)以合成
 为例,其合成反应为:
为例,其合成反应为:

①已知
 的燃烧热为
的燃烧热为 ;
;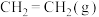 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
 、
、 、
、 表示)
表示)②该反应在较低温度时能自发进行,可能原因为
③在体积为V L的恒容密闭容器中,以
 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为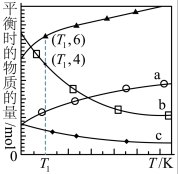
 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:第一步:
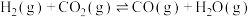

第二步:
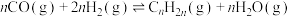

第二步的机理及可能的副反应如图:
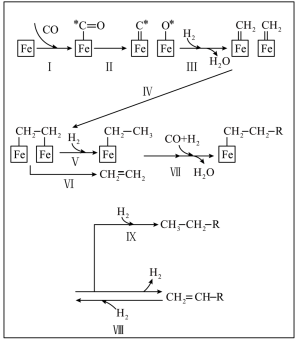
 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol①下列说法不正确的是
A.第一步反应中,在催化剂表面,
 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生
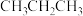 等副产品
等副产品②在其他条件恒定的情况下,适当降低原料气的流速,
 的转化率将
的转化率将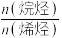 将
将
您最近一年使用:0次
8 .
(1)现有如下待完成的反应:

①判断该反应物手性中心的构型__________ 。
②画出此单溴化反应所有产物的结构简式__________ 。
(2)变色眼镜片在阳光下显深色,从而保护人的眼睛:当人进入室内后,镜片逐步转变为无色透明,有利于在弱光下观察周边事物。日前流行的一种变色眼镜的变色原理如下:
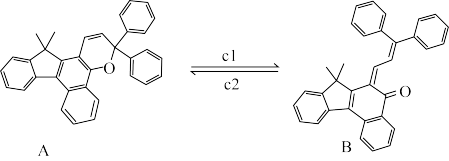
判断上述变色过程中反应条件cl和c2,简述理由__________ 。
(3)维生素C普遍存在于动植物中,在动物肝脏中以葡萄糖为原料经四步反应合成;工业生产的方式也是以葡萄糖为原料经以下过程合成的:
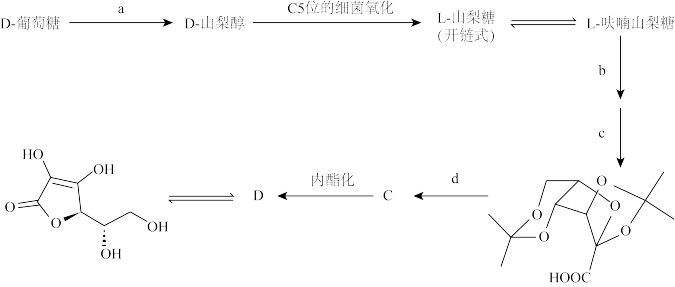
①写出反应a和b的具体条件(可以不写溶剂)__________ 。
②画出L—山梨糖和化合物C的Fischer 投影式__________ 。
(4)以下给出四个取代反应,右侧是其中某-反应的反应势能图:
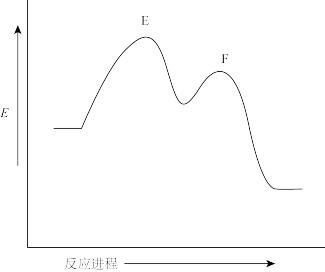
Ⅰ.
Ⅱ.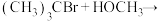
Ⅲ.
Ⅳ.
① 指出哪个反应与此反应势能图相符__________ 。
②画出过渡态E和F的结构式__________ 、__________ 。
(1)现有如下待完成的反应:

①判断该反应物手性中心的构型
②画出此单溴化反应所有产物的结构简式
(2)变色眼镜片在阳光下显深色,从而保护人的眼睛:当人进入室内后,镜片逐步转变为无色透明,有利于在弱光下观察周边事物。日前流行的一种变色眼镜的变色原理如下:

判断上述变色过程中反应条件cl和c2,简述理由
(3)维生素C普遍存在于动植物中,在动物肝脏中以葡萄糖为原料经四步反应合成;工业生产的方式也是以葡萄糖为原料经以下过程合成的:

①写出反应a和b的具体条件(可以不写溶剂)
②画出L—山梨糖和化合物C的Fischer 投影式
(4)以下给出四个取代反应,右侧是其中某-反应的反应势能图:

Ⅰ.

Ⅱ.
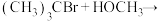
Ⅲ.

Ⅳ.

① 指出哪个反应与此反应势能图相符
②画出过渡态E和F的结构式
您最近一年使用:0次
9 . 轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,它的生产以白云石(主要成分是碳酸镁钙)为原料。
(1)石灰石和卤水长期作用形成白云石,写出该反应的离子方程式_______ 。
(2)如图是省略了部分原子或离子的白云石晶胞。
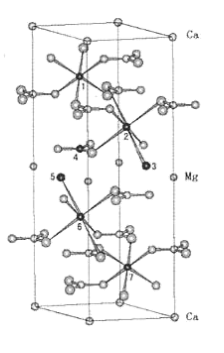
①写出图中标有1、2、3、4、5、6、7的原子或离子的元素符号_______ 。
②在答题纸的图中补上与3、5原子或离子相邻的其他原子或离子,再用连线表示它们与Mg的配位关系_______ 。
(3)白云石分解所得CaO和MgO,加水制成Mg(OH)2和Ca(OH)2的悬浮液,通入适量CO2(g),实现Ca2+、Mg2+的分离。
已知:
计算下列反应的平衡常数K_______
Mg(OH)2+Ca(OH)2+3CO2=Mg2++2HCO +CaCO3+H2O
+CaCO3+H2O
(4)25℃,100kPaCO2在水中溶解度为0.0343mol·L-1。将100molMgO和100molCaO加水制成1000L悬浮液,通入CO2,使Mg2+浓度达到0.100mol·L-1,Ca2+浓度不超过10-4mol·L-1,且不生成MgCO3沉淀。通过计算说明如何控制CO2的压力_______ (假设CO2在水中溶解符合亨利定律)。
(5)Mg(HCO3)2溶液加热分解,得到产品轻质碳酸镁(实为碱式碳酸盐)。18.26g轻质碳酸镁纯样品经高温分解完全后得8.06g固体,放出3.36L(折合成标准状况)二氧化碳,通过推算,写出轻质碳酸镁的化学式_______ (提示:轻质碳酸镁化学式所含的离子或分子数目为简单整数)。(相对原子质量:Mg-24.3;C-12.0;O-16.0;H-1.01)
(1)石灰石和卤水长期作用形成白云石,写出该反应的离子方程式
(2)如图是省略了部分原子或离子的白云石晶胞。

①写出图中标有1、2、3、4、5、6、7的原子或离子的元素符号
②在答题纸的图中补上与3、5原子或离子相邻的其他原子或离子,再用连线表示它们与Mg的配位关系
(3)白云石分解所得CaO和MgO,加水制成Mg(OH)2和Ca(OH)2的悬浮液,通入适量CO2(g),实现Ca2+、Mg2+的分离。
已知:
| Mg(OH)2 | Ksp=5.61×10-12 |
| Ca(OH)2 | Ksp=5.50×10-6 |
| MgCO3 | Ksp=6.82×10-6 |
| CaCO3 | Ksp=4.96×10-9 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
计算下列反应的平衡常数K
Mg(OH)2+Ca(OH)2+3CO2=Mg2++2HCO
 +CaCO3+H2O
+CaCO3+H2O(4)25℃,100kPaCO2在水中溶解度为0.0343mol·L-1。将100molMgO和100molCaO加水制成1000L悬浮液,通入CO2,使Mg2+浓度达到0.100mol·L-1,Ca2+浓度不超过10-4mol·L-1,且不生成MgCO3沉淀。通过计算说明如何控制CO2的压力
(5)Mg(HCO3)2溶液加热分解,得到产品轻质碳酸镁(实为碱式碳酸盐)。18.26g轻质碳酸镁纯样品经高温分解完全后得8.06g固体,放出3.36L(折合成标准状况)二氧化碳,通过推算,写出轻质碳酸镁的化学式
您最近一年使用:0次
名校
10 . 石油的裂解是石油化工的重要方法之王,石油的裂解产物是合成材料的重要的基础原料。例如工业上以丙烯为原料可制得一种重要合成橡胶IR和一种合成树脂X。
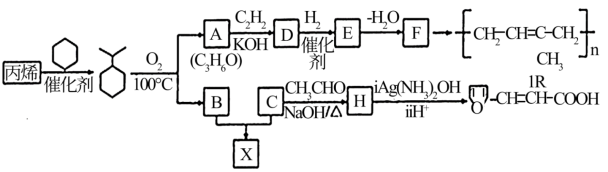
B的分子式是C6H6O,可与NaOH溶液反应。
已知以下信息:
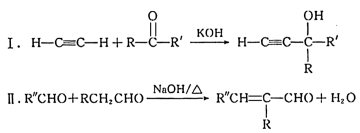
(—R、—R’、—R’’表示可能相同或可能不同的原子或原子团。)
Ⅲ.同一碳原子上有两个碳碳双键时,分子不稳定。
请回答下列问题。
在一定条件下,丙烯可与下列物质反应的是__________ 。
A、H2O B、NaOH溶液 C、Br2的CCl4溶液 D、酸性KMnO4溶液
(2)A与C2H2合成D的化学方程式是___________________ ,反应类型是______________ 。
(3)E、F中均含有碳碳双键,则E的结构简式是_____________ 。
(4)H的结构简式是_____________ 。
(5)B与C在一定条件下反应生成合成树脂X的化学方程式是_____________ 。
(6) 有多种同分异构体,符合下列要求的有
有多种同分异构体,符合下列要求的有___________ 种,其中在核磁共振氢谱中只出现四组峰的有_________ 种。
能与FeCl3溶液反应显紫色 ②只能发生银镜反应,不能发生水解反应

B的分子式是C6H6O,可与NaOH溶液反应。
已知以下信息:

(—R、—R’、—R’’表示可能相同或可能不同的原子或原子团。)
Ⅲ.同一碳原子上有两个碳碳双键时,分子不稳定。
请回答下列问题。
在一定条件下,丙烯可与下列物质反应的是
A、H2O B、NaOH溶液 C、Br2的CCl4溶液 D、酸性KMnO4溶液
(2)A与C2H2合成D的化学方程式是
(3)E、F中均含有碳碳双键,则E的结构简式是
(4)H的结构简式是
(5)B与C在一定条件下反应生成合成树脂X的化学方程式是
(6)
 有多种同分异构体,符合下列要求的有
有多种同分异构体,符合下列要求的有能与FeCl3溶液反应显紫色 ②只能发生银镜反应,不能发生水解反应
您最近一年使用:0次
2017-03-06更新
|
606次组卷
|
3卷引用:第28届(2014年)全国高中生化学竞赛河南省预赛试题



