2025高三上·全国·专题练习
1 . 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为___________ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
 2O3。
2O3。(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
2 . 用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.400 0 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(滴定反应为I2+2S2O =S4O
=S4O +2I-)
+2I-)
(1)写出生成白色CuI沉淀的离子方程式:___________ 。
(2)该样品中CuCl2·2H2O的质量分数为___________ 。
 =S4O
=S4O +2I-)
+2I-)(1)写出生成白色CuI沉淀的离子方程式:
(2)该样品中CuCl2·2H2O的质量分数为
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
3 . 质量、物质的量、物质的量浓度等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)标准状况下,17g NH3的体积为___________ ,含有氢原子个数为___________ ,它与标准状况下___________ L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为___________ ,R的相对原子质量为___________ 。
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为___________ 。
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为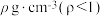 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
(6)将a L Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入b mol BaCl2溶液使溶液中的SO 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为___________ 。
(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为___________ mL。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为
(2)标准状况下,17g NH3的体积为
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为
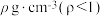 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。A.溶质的质量分数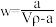 |
B.溶质的物质的量浓度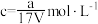 |
C.溶液密度ρ可表示为 |
| D.上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w |
 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为
您最近一年使用:0次
4 . 肼能除去锅炉用水中的溶解氧(即溶解的氧气),以减缓锅炉锈蚀。已知某锅炉用水中的溶解氧的浓度为8.0mg·L-1,若反应过程中肼全部转化为氮气,则每处理1m3该锅炉用水,需要消耗肼的质量为多少?______ (写出计算过程)。
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
5 . 乙酸是基本的有机化工原料,乙酸制氢具有重要意义,制氢过程发生如下反应:
热裂解反应Ⅰ: CH3COOH(g) 2CO (g)+ 2H2(g) ΔH1
2CO (g)+ 2H2(g) ΔH1
脱羧基反应Ⅱ:CH3COOH(g) CO2 (g)+CH4(g) ΔH2
CO2 (g)+CH4(g) ΔH2
若利用合适的催化剂发生热裂解反应Ⅰ和脱羧基反应Ⅱ,温度为TK时达到平衡,总压强为p kPa,乙酸体积分数为20%,其中热裂解反应Ⅰ消耗的乙酸占投入量的20%,脱羧基反应Ⅱ的平衡常数Kp为_____ kPa (Kp为以分压表示的平衡常数)。
热裂解反应Ⅰ: CH3COOH(g)
 2CO (g)+ 2H2(g) ΔH1
2CO (g)+ 2H2(g) ΔH1脱羧基反应Ⅱ:CH3COOH(g)
 CO2 (g)+CH4(g) ΔH2
CO2 (g)+CH4(g) ΔH2若利用合适的催化剂发生热裂解反应Ⅰ和脱羧基反应Ⅱ,温度为TK时达到平衡,总压强为p kPa,乙酸体积分数为20%,其中热裂解反应Ⅰ消耗的乙酸占投入量的20%,脱羧基反应Ⅱ的平衡常数Kp为
您最近一年使用:0次
2024高三下·全国·专题练习
6 . 一定条件下,CO2与H2反应可合成CH2=CH2,2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g),该反应分两步进行:
CH2=CH2(g)+4H2O(g),该反应分两步进行:
i.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
ii.2CO(g)+4H2(g) CH2=CH2(g)+2H2O(g) ΔH2
CH2=CH2(g)+2H2O(g) ΔH2
T℃,压强恒定为100kPa时,将n(CO2):n(H2)=1:3的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
CO2的平衡转化率为________ ,反应i的平衡常数Kp=________ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)
 CH2=CH2(g)+4H2O(g),该反应分两步进行:
CH2=CH2(g)+4H2O(g),该反应分两步进行:i.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1ii.2CO(g)+4H2(g)
 CH2=CH2(g)+2H2O(g) ΔH2
CH2=CH2(g)+2H2O(g) ΔH2T℃,压强恒定为100kPa时,将n(CO2):n(H2)=1:3的混合气体和催化剂投入反应器中,达平衡时,部分组分的物质的量分数如表所示:
| 组分 | H2 | CO | CH2=CH2 |
| 物质的量分数(%) |  |  |  |
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
7 . 一定条件下,反应:CH3CH2CH3(g)  CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为:
CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为: ,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是
,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是_______ (填“Ⅰ”或“Ⅱ”)。570℃时,KP=_______ MPa (保留2位有效数字)。

 CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为:
CH2=CHCH3(g)+H2(g) △H1=+123.8kJ/mol;丙烷平衡转化率x与平衡常数Kp的关系可表示为: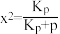 ,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是
,式中p为系统总压。p分别为0.10MPa和0.010MPa时,丙烷平衡转化率与温度的关系如图所示,其中表示0.10MPa下的关系曲线是
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
8 . 1200K时,假定体系内只有反应C40H12 (g) C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为
C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为
C40H10(g) + H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
9 . 对于基元反应,如aA+bB cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
反应Ⅱ:8NH3(g)+6NO2(g) 7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)ΔH3=+182.6kJ·mol-1
对于基元反应Ⅳ:2NO(g)+O2(g) 2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
(1)ΔH4=______ kJ·mol-1
(2)计算653K时的平衡常数K=______ 。
(3)653K时,若NO的浓度为0.006mol·L-1,O2的浓度为0.290mol·L-1,则正反应速率为______ mol·L-1·s-1
 cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:
cC+dD,反应速率v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),其中k正、k逆是取决于温度的速率常数。已知:反应Ⅰ:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1
4NO(g)+6H2O(g)ΔH1=-902kJ·mol-1反应Ⅱ:8NH3(g)+6NO2(g)
 7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1
7N2(g)+12H2O(g)ΔH2=-2740kJ·mol-1反应Ⅲ:N2(g)+O2(g)=2NO(g)ΔH3=+182.6kJ·mol-1
对于基元反应Ⅳ:2NO(g)+O2(g)
 2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1
2NO2(g)ΔH4,在653K时,速率常数k正=2.6×103L2·mol-2·s-1,k逆=4.1×103L·mol-1·s-1(1)ΔH4=
(2)计算653K时的平衡常数K=
(3)653K时,若NO的浓度为0.006mol·L-1,O2的浓度为0.290mol·L-1,则正反应速率为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
10 . 空气中CO2含量的控制和CO2资源利用具有重要意义。
(1)已知25℃、101 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
该反应的速率方程为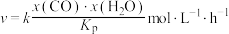 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后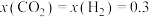 ,此时反应Ⅰ的速率
,此时反应Ⅰ的速率
______  (用含k的代数式表示)。
(用含k的代数式表示)。
(1)已知25℃、101
 下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1该反应的速率方程为
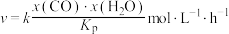 ,其中x表示相应气体的物质的量分数,
,其中x表示相应气体的物质的量分数, 为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后
为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后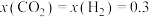 ,此时反应Ⅰ的速率
,此时反应Ⅰ的速率
 (用含k的代数式表示)。
(用含k的代数式表示)。
您最近一年使用:0次



