2025高三上·全国·专题练习
1 . 向500 mL氢氧化钠溶液中投入10.8 g铝,二者恰好完全反应,计算回答:
(1)铝的物质的量是___________ 。
(2)氢氧化钠溶液的物质的量浓度是___________ 。
(3)在标准状况下生成氢气的体积是___________ 。
(1)铝的物质的量是
(2)氢氧化钠溶液的物质的量浓度是
(3)在标准状况下生成氢气的体积是
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
2 . 把10.2 g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算:
(1)该合金中铝的质量分数是___________ 。
(2)该合金中镁与铝的物质的量之比是___________ 。
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是___________ 。
(1)该合金中铝的质量分数是
(2)该合金中镁与铝的物质的量之比是
(3)该合金溶于足量的盐酸溶液中,标准状况下产生氢气的体积是
您最近一年使用:0次
2025高三上·全国·专题练习
3 . 一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。称取TiO2样品0.60 g,消耗0.20 mol·L-1的NH4Fe(SO4)2溶液36.75 mL,则样品中TiO2的质量分数是_______ 。
您最近一年使用:0次
2025高三上·全国·专题练习
4 . 已知MnO2与浓盐酸反应的化学方程式为MnO2+ 4HCl(浓) MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)被氧化的HCl占HCl总量的___________ 。
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为___________ (设NA为阿伏加德罗常数的值)。
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成___________ g沉淀。
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:(1)该反应的离子方程式为
(2)被氧化的HCl占HCl总量的
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
5 . 用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.400 0 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(滴定反应为I2+2S2O =S4O
=S4O +2I-)
+2I-)
(1)写出生成白色CuI沉淀的离子方程式:___________ 。
(2)该样品中CuCl2·2H2O的质量分数为___________ 。
 =S4O
=S4O +2I-)
+2I-)(1)写出生成白色CuI沉淀的离子方程式:
(2)该样品中CuCl2·2H2O的质量分数为
您最近一年使用:0次
2025高三上·全国·专题练习
6 . 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为___________ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为___________ L。
 2O3。
2O3。(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为
您最近一年使用:0次
2025高三上·全国·专题练习
解题方法
7 . 质量、物质的量、物质的量浓度等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)标准状况下,17g NH3的体积为___________ ,含有氢原子个数为___________ ,它与标准状况下___________ L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为___________ ,R的相对原子质量为___________ 。
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为___________ 。
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为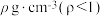 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
(6)将a L Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入b mol BaCl2溶液使溶液中的SO 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为___________ 。
(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为___________ mL。
(1)质量之比为16:7:6的三种气体SO2、CO、NO。分子个数之比为
(2)标准状况下,17g NH3的体积为
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
(4)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为
(5)在t℃时将a g NH3 完全溶于水得到V mL溶液,该溶液的密度为
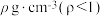 ;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。
;质量分数为w,物质的量浓度为c mol·L-1。下列计算结果正确的是___________。A.溶质的质量分数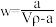 |
B.溶质的物质的量浓度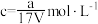 |
C.溶液密度ρ可表示为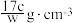 |
| D.上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w |
 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c molNH3,则原溶液中Al3+的物质的量浓度为(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为
您最近一年使用:0次
名校
解题方法
8 . 氮元素的单质及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
I.一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g) 2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
(1)用A的浓度变化表示反应的平均速率:___________ 。
(2)在2 min末,B的浓度为___________ 。
II.某反应过程的能量变化如下图所示。
(3)反应过程___________ (填“a”或“b”)有催化剂参与。
(4)①该反应为___________ 反应(填“放热”或“吸热”)。
②已知:
反应i:
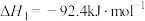
反应ii:
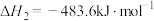
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为___________ 。
III.已知反应i断开化学键所需的能量如下表。
(5)则断开 N—H键所需的能量是
N—H键所需的能量是___________ 。
I.一定条件下,在2 L密闭容器中发生反应:3A(g) + B(g)
 2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。
2C(g)。开始时加入4 mol A,6 mol B,2molC,在2 min末测得C的物质的量是3mol。(1)用A的浓度变化表示反应的平均速率:
(2)在2 min末,B的浓度为
II.某反应过程的能量变化如下图所示。
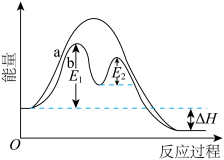
(3)反应过程
(4)①该反应为
②已知:
反应i:

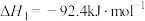
反应ii:

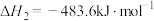
则氨气完全燃烧生成氮气和水蒸气的热化学方程式为
III.已知反应i断开化学键所需的能量如下表。
| 化学键 |  | H—H | N—H |
键能/ | 945 | 436 | ? |
(5)则断开
 N—H键所需的能量是
N—H键所需的能量是
您最近一年使用:0次
名校
解题方法
9 . 为测定某铝镁铜合金中铝、镁的质量分数,进行如下实验(忽略反应中水的蒸发):①向30.0g合金粉末中加入200g 30.0% NaOH溶液,充分反应后,称得固液混合物质量为227.0g。②再向混合液中加入过量稀硫酸,充分反应后剩余固体洗涤干燥后称得质量为0.6g。(计算结果保留一位小数)
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为___________ mol/L。
(2)30.0g合金中Al的质量为___________ g。
(3)合金中Mg元素的质量分数为___________ 。
(1)查得室温下30.0% NaOH溶液密度为1.33g/mL,则该NaOH溶液的物质的量浓度为
(2)30.0g合金中Al的质量为
(3)合金中Mg元素的质量分数为
您最近一年使用:0次
10 . 常温下, 、HCOOH(甲酸)、二元弱酸
、HCOOH(甲酸)、二元弱酸 的电离常数见下表,下列说法正确的是
的电离常数见下表,下列说法正确的是
 、HCOOH(甲酸)、二元弱酸
、HCOOH(甲酸)、二元弱酸 的电离常数见下表,下列说法正确的是
的电离常数见下表,下列说法正确的是| 分子式 |  | HCOOH |  |
| 电离常数 |  | 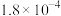 |  、 、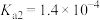 |
A.等物质的量浓度的几种溶液pH大小关系: |
B.HCOONa溶液中滴入少量 ,发生反应 ,发生反应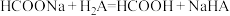 |
C.NaHA溶液中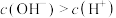 |
D. 的电离常数小于 的电离常数小于 |
您最近一年使用:0次



