真题
名校
1 . 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S+6KOH 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
K2Sx(x=2~6)
S+ K2SO3 K2S2O3
K2S2O3
请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=______ 。
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=______ 。(写出计算过程)
3S+6KOH
 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O(x-1)S+K2S
 K2Sx(x=2~6)
K2Sx(x=2~6)S+ K2SO3
 K2S2O3
K2S2O3请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=
您最近一年使用:0次
2021-01-09更新
|
4103次组卷
|
12卷引用:浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试化学(学考)试题
浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试化学(学考)试题2021年1月新高考浙江化学高考真题(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题(已下线)专题18.化学计算-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年1月浙江高考化学试题变式题26-31(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)浙江省宁波市鄞州中学(宁波鄞州蓝青高级中学)2023-2024学年高一上学期12月月考化学学科试题
名校
解题方法
2 . 某合金(仅含铜、铁)中铜和铁的物质的量之和为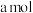 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入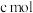 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。
(1)若产生标准状况下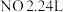 ,则反应转移电子的物质的量为
,则反应转移电子的物质的量为________________ 
(2)若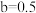 ,溶液中的
,溶液中的 与
与 的物质的量之比
的物质的量之比 ,标准状况下产生
,标准状况下产生 ,
,
___ 
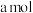 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入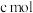 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。(1)若产生标准状况下
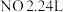 ,则反应转移电子的物质的量为
,则反应转移电子的物质的量为
(2)若
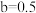 ,溶液中的
,溶液中的 与
与 的物质的量之比
的物质的量之比 ,标准状况下产生
,标准状况下产生 ,
,

您最近一年使用:0次
2022-06-17更新
|
1399次组卷
|
3卷引用:浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题
浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题浙江省浙江大学附属中学2021-2022学年高三下学期5月份仿真模拟化学试题 (已下线)【知识图鉴】单元讲练测必修第二册第五单元 03巩固练
名校
解题方法
3 . 完成下列问题。
(1)已知完全断裂物质的量均为1mol的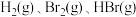 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为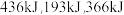 。则在该条件下,
。则在该条件下,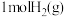 与
与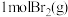 完全反应会
完全反应会_______ (填“吸收”或“放出”)_______  能量。
能量。
(2)将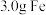 和
和 的混合粉末完全溶于
的混合粉末完全溶于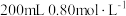 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:
①则混合粉末中Fe的物质的量是_______ mol;
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是_______ g。
(1)已知完全断裂物质的量均为1mol的
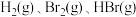 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为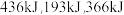 。则在该条件下,
。则在该条件下,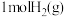 与
与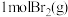 完全反应会
完全反应会 能量。
能量。(2)将
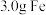 和
和 的混合粉末完全溶于
的混合粉末完全溶于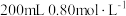 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:①则混合粉末中Fe的物质的量是
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是
您最近一年使用:0次
4 . 将一定量 通入
通入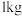 质量分数为
质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:
(1) 溶液中
溶液中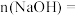
___________  。
。
(2)已知混合溶液中 ,则混合溶液中
,则混合溶液中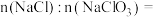
___________ 。
(3)所通 在标准状况下的体积为
在标准状况下的体积为___________ L。
 通入
通入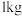 质量分数为
质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:(1)
 溶液中
溶液中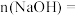
 。
。(2)已知混合溶液中
 ,则混合溶液中
,则混合溶液中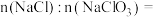
(3)所通
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2022-05-04更新
|
906次组卷
|
4卷引用:浙江省舟山市普陀中学2023届高三返校考试化学试题
名校
解题方法
5 . 恒温恒容下,将2 mol红棕色气体A和1.5 mol无色气体B通入体积为1 L的密闭容器中发生如下反应: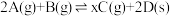 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______ mol/(L·min)
(2)x=_______ ;A的转化率与B的转化率之比为_______
(3)写出该温度下的平衡常数表达式_______ (用相关字母表示),数值_______
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)_______ v(逆)。(填“>”、“=”或“<”)
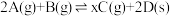 ,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。
,2 min时反应达到平衡状态,此时剩余1.1 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)写出该温度下的平衡常数表达式
(4)向平衡后的容器中继续充入0.8 molA(g)、0.9 molB(g)、0.8 molC(g)、1.2mol D(s),此时,v(正)
您最近一年使用:0次
2022-06-02更新
|
806次组卷
|
7卷引用:辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题
辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题江苏省徐州市沛县2021-2022学年高二下学期第一次学情调研化学试题(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)江西省抚州市南城县第二中学2022-2023学年高二上学期第一次月考化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题
6 . 32g铜投入到100mL一定浓度的硝酸溶液中,两者恰好反应,若共收集到NO和NO2的混合气体8.96 L气体(标准状况)。
(1)计算产生NO的体积(标准状况)___________ ;
(2)硝酸溶液的物质的量浓度为___________ 。
(1)计算产生NO的体积(标准状况)
(2)硝酸溶液的物质的量浓度为
您最近一年使用:0次
2022-09-25更新
|
832次组卷
|
2卷引用:浙江省玉环市玉城中学2021-2022学年高一下学期开学考试化学试题
7 . 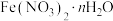 可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有
可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有 、
、 、
、 、
、 ,其中水的质量为6.300g,残留的固体产物是
,其中水的质量为6.300g,残留的固体产物是 ,质量为4.800g。
,质量为4.800g。
(1)n=_______ (写出计算过程)。
(2)在标准状况下气体产物中 的体积为
的体积为_______ L。
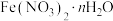 可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有
可用作媒染剂、医药、分析试剂、催化剂等,某同学设计实验确定其结晶水数目。用电子天平称取样品17.280g,一定条件下,经热分解测得气体产物中有 、
、 、
、 、
、 ,其中水的质量为6.300g,残留的固体产物是
,其中水的质量为6.300g,残留的固体产物是 ,质量为4.800g。
,质量为4.800g。(1)n=
(2)在标准状况下气体产物中
 的体积为
的体积为
您最近一年使用:0次
解题方法
8 . 用如图所示的实验装置测定某有机物样品实验式的方法如下:将27.6 g有机物样品放在装置C的硬质玻璃管中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
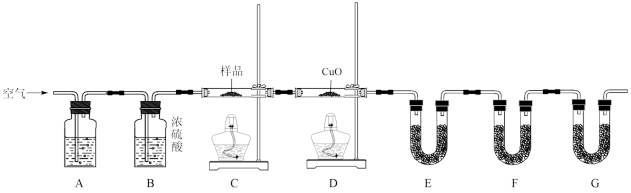
测得的数据如表所示:
(1)燃烧产物中水的物质的量为___________ 。
(2)该有机物的实验式是___________ (写出计算过程)。

测得的数据如表所示:
| 装置 | 实验前/g | 实验后/g |
| E | 125.6 | 143.6 |
| F | 183.2 | 253.6 |
(1)燃烧产物中水的物质的量为
(2)该有机物的实验式是
您最近一年使用:0次
2022-02-23更新
|
676次组卷
|
3卷引用:浙江省浙南名校联考2021-2022学年下学期高三返校联考化学试题
浙江省浙南名校联考2021-2022学年下学期高三返校联考化学试题(已下线)考点31 研究有机物的一般方法-备战2023年高考化学一轮复习考点帮(全国通用)浙江省浙南联盟2022届高三第二次模拟考试化学试题
名校
9 . 向27.2gCu和Cu2O的混合溶液中加入某浓度的稀硝酸0.5L,固体完全溶解,生成NO和Cu(NO3)2。在所得溶液中加入1.0mol/LNaOH溶液1.0L,得到39.2g沉淀,且此时溶液呈中性。请回答:
(1)生成的NO气体在标况下的体积为_____ L。
(2)所加稀硝酸的物质的量浓度为_____ mol/L。
(1)生成的NO气体在标况下的体积为
(2)所加稀硝酸的物质的量浓度为
您最近一年使用:0次
解题方法
10 . 硫酸是重要化工原料之一,研究人员对其生产开展研究。请回答:
(1)工业上一般采用硫铁矿或硫黄粉为原料制备硫酸。
① ,
, 下,下列反应
下,下列反应


则反应 能自发进行的条件是
能自发进行的条件是_______ 。
②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)_______ 。
A.在制备 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
B.两种方法产生的气体都不需要干燥
C.在 转化为
转化为 阶段,控制温度在
阶段,控制温度在 左右的主要原因是为了提高反应速率和平衡转化率
左右的主要原因是为了提高反应速率和平衡转化率
D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: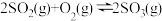
①不同温度下,具有一定能量的分子百分数与分子能量的关系如图所示,E表示 温度下分子的平均能量,
温度下分子的平均能量, 是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
_______  (填“>”、“=”或“<”)。若
(填“>”、“=”或“<”)。若 温度下使用催化剂,请在图中画出相应的变化:
温度下使用催化剂,请在图中画出相应的变化:_______ 。

②某温度下,假设进入接触室内 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少
的物质的量比为1∶1,反应达到平衡时压强减少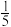 ;保持温度不变,欲使
;保持温度不变,欲使 的平衡转化率提高到90%,则开始时加入
的平衡转化率提高到90%,则开始时加入 和
和 的物质的量比为应为
的物质的量比为应为_______ (计算结果保留1位小数)。
③ 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
步骤Ⅰ:
步骤Ⅱ:_______ 。
步骤Ⅲ:
(3) 的平衡转化率与反应温度和压强的关系如下图。
的平衡转化率与反应温度和压强的关系如下图。

①实际生产选择图中A点的反应条件,不选择B、C点的理由分别是_______ 。
②将组成(物质的量分数)为 和
和 的气体通入反应器,在温度t、压强p条件下进行反应:
的气体通入反应器,在温度t、压强p条件下进行反应: 。平衡时,若
。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)(用含 的代数式表示)。
的代数式表示)。
(1)工业上一般采用硫铁矿或硫黄粉为原料制备硫酸。
①
 ,
, 下,下列反应
下,下列反应

则反应
 能自发进行的条件是
能自发进行的条件是②两种方法在制备工艺上各有其优缺点,下列选项正确的是(可多选)
A.在制备
 阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多
阶段,硫铁矿法产生较多的矿渣,且生成的气体净化处理比硫黄粉法复杂得多B.两种方法产生的气体都不需要干燥
C.在
 转化为
转化为 阶段,控制温度在
阶段,控制温度在 左右的主要原因是为了提高反应速率和平衡转化率
左右的主要原因是为了提高反应速率和平衡转化率D.将原料粉碎后送入沸腾炉中,可以提高原料的利用率
(2)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: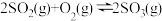
①不同温度下,具有一定能量的分子百分数与分子能量的关系如图所示,E表示
 温度下分子的平均能量,
温度下分子的平均能量, 是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
是活化分子具有的最低能量,阴影部分的面积反映活化分子的多少,则图中
 (填“>”、“=”或“<”)。若
(填“>”、“=”或“<”)。若 温度下使用催化剂,请在图中画出相应的变化:
温度下使用催化剂,请在图中画出相应的变化:
②某温度下,假设进入接触室内
 的物质的量恒定。当
的物质的量恒定。当 和
和 的物质的量比为1∶1,反应达到平衡时压强减少
的物质的量比为1∶1,反应达到平衡时压强减少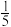 ;保持温度不变,欲使
;保持温度不变,欲使 的平衡转化率提高到90%,则开始时加入
的平衡转化率提高到90%,则开始时加入 和
和 的物质的量比为应为
的物质的量比为应为③
 催化氧化
催化氧化 的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:
的反应过程可分为三步,请写出步骤Ⅱ的化学方程式:步骤Ⅰ:

步骤Ⅱ:
步骤Ⅲ:

(3)
 的平衡转化率与反应温度和压强的关系如下图。
的平衡转化率与反应温度和压强的关系如下图。
①实际生产选择图中A点的反应条件,不选择B、C点的理由分别是
②将组成(物质的量分数)为
 和
和 的气体通入反应器,在温度t、压强p条件下进行反应:
的气体通入反应器,在温度t、压强p条件下进行反应: 。平衡时,若
。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



