名校
1 . 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾为原料,采用电化学制备重铬酸钾。制备装置如下图所示:
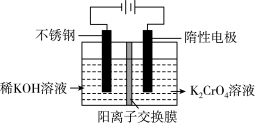
制备原理:2CrO (黄色)+2H+⇌Cr2O
(黄色)+2H+⇌Cr2O (橙色)+H2O
(橙色)+H2O
(1)通电后阳极室产生的现象为_____________ ,电极反应式是__________ 。
(2)该制备过程总反应的离子方程式可表示为4CrO +4H2O=2Cr2O
+4H2O=2Cr2O +4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为
+4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为________ ;该过程中反应转移的电子数目为___________ ;此时阳极室与阴极室溶液质量变化之差(△m阴极室-△m 阳极室)为____ g。

制备原理:2CrO
 (黄色)+2H+⇌Cr2O
(黄色)+2H+⇌Cr2O (橙色)+H2O
(橙色)+H2O(1)通电后阳极室产生的现象为
(2)该制备过程总反应的离子方程式可表示为4CrO
 +4H2O=2Cr2O
+4H2O=2Cr2O +4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为
+4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为
您最近一年使用:0次
2 . 某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)
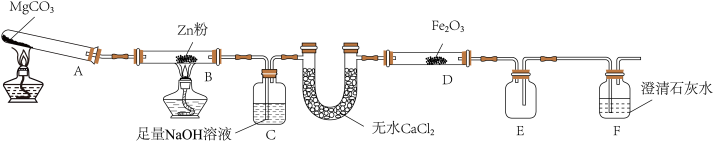
(1)图中盛无水CaCl2的仪器名称为______ 装置B中的化学反应方程式为_______ 。
(2)装置C中发生反应的离子方程式为_________ ,处理尾气的方法为________ 。
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
①乙组得到的黑色粉末成分是________ 。
②根据甲组实验现象写出甲组步骤1中反应的离子方式__________ 。
③乙组步骤4中,溶液变红的原因为________ ,溶液褪色可能的原因________ 及其验证方法为________ 。

(1)图中盛无水CaCl2的仪器名称为
(2)装置C中发生反应的离子方程式为
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末成分是
②根据甲组实验现象写出甲组步骤1中反应的离子方式
③乙组步骤4中,溶液变红的原因为
您最近一年使用:0次
2024高三下·全国·专题练习
3 .  作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:
(1)取 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、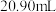 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为_______ 。
 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: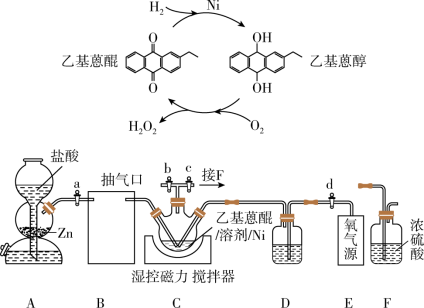
 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:(1)取
 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、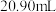 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为
您最近一年使用:0次
名校
解题方法
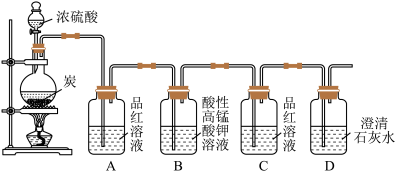
4 . 某同学欲验证碳与浓硫酸反应产物的性质。现已将装置如图连接,请回答下列问题。
(1)烧瓶中发生反应的化学反应方程式是___________ 。
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是_____ ,通过洗气瓶C中无现象和___ 的现象,证明反应有_______ (填化学式)生成。
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一______ (填名称)具有______ 的性质。
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到__________ 。
(1)烧瓶中发生反应的化学反应方程式是
(2)实验中两次使用到品红溶液,其目的不同。A的使用目的是
(3)洗气瓶B中溶液颜色变浅,说明碳与浓硫酸反应的产物之一
(4)实验完成后,取出洗气瓶A中的无色溶液于试管中,加热,可观察到
您最近一年使用:0次
2020-01-05更新
|
361次组卷
|
3卷引用:河北省唐山市丰润车轴山中学2019—2020学年高一上学期12月月考化学试题
2012·上海徐汇·二模
解题方法
5 . 已知 NH3和 Cl2在常温下可快速反应生成氮气:2 NH3 + 3Cl2 → N2 + 6HCl。当 Cl2和 NH3 比例不同时,产物有差异。
(1)若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则 Cl2 和 NH3 的最佳比例为____________ 。该反应可用于检验化工生产中氯气是否泄漏。如氯气有少量泄漏,用氨气检验时有明显现象,此过程中发生反应的Cl2和NH3的体积比范围为___________ 。
(2)体积为1.12 L,质量为3.335 g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672 L(其中Cl2体积分数为50%)(气体体积均为标准状况下测定)。则原混合气体中N2的体积为_____________ mL。
(3)根据第(2)题数据,计算被氧化的NH3的质量。下面是两位学生从不同角度解题时所列的第一步算式,请判断他们所列未知数X分别表示什么量,并填写在表格内:(单位没列出)
(4)有Cl2和N2的混合气体,其中N2的体积分数为x,将1L该混合气体与1L氨气混合,讨论x取不同范围的数值时,所得气体体积y与x的关系式(所有气体体积均在相同状况下测定)。______________
(1)若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则 Cl2 和 NH3 的最佳比例为
(2)体积为1.12 L,质量为3.335 g的Cl2和N2的混合气体通过浓氨水后,体积变为0.672 L(其中Cl2体积分数为50%)(气体体积均为标准状况下测定)。则原混合气体中N2的体积为
(3)根据第(2)题数据,计算被氧化的NH3的质量。下面是两位学生从不同角度解题时所列的第一步算式,请判断他们所列未知数X分别表示什么量,并填写在表格内:(单位没列出)
| 学生编号 | 所列第一步算式 | 未知数X表示的意义 |
| 甲 | 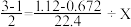 | |
| 乙 |  | |
(4)有Cl2和N2的混合气体,其中N2的体积分数为x,将1L该混合气体与1L氨气混合,讨论x取不同范围的数值时,所得气体体积y与x的关系式(所有气体体积均在相同状况下测定)。
您最近一年使用:0次
名校
6 . H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
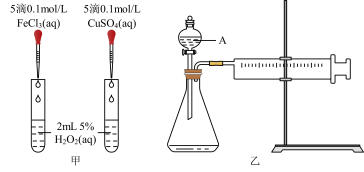
(1)若利用图甲装置,可通过观察__________ 现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________ 。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________ 。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________ ,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________ 。
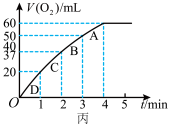
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________ 。H2O2初始物质的量浓度为_______ (保留两位小数)。

(1)若利用图甲装置,可通过观察
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:

您最近一年使用:0次
2019-09-20更新
|
445次组卷
|
10卷引用:云南省盈江县一中2019-2020学年高二上学期开学考试化学试题
云南省盈江县一中2019-2020学年高二上学期开学考试化学试题人教版高中化学必修二第二单元《化学反应与能量》测试卷2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷2020年人教版高中化学必修2第二章《化学反应与能量》测试卷12020年春季苏教版高中化学必修2专题二《化学反应与能量转化》测试卷安徽省定远县育才学校2019-2020学年高一下学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)云南省普洱市第一中学2021-2022学年高一下学期3月份考试化学试题云南省石屏县第一中学2021-2022学年高一下学期3月份考试化学试题云南省广南县第一中学校2021-2022学年高一下学期3月份考试化学试题
解题方法
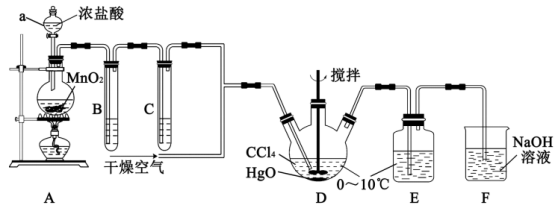
7 . 次氯酸 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为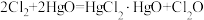 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:① 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;
②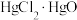 是难溶于水的固体。
是难溶于水的固体。
(1)仪器a的名称是___________ 。写出装置A中反应的离子方程式___________ 。
(2)装置B的作用是___________ ,装置C中盛装的试剂是___________ 。
(3)D中通入 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为___________ 。
(4)有效含氯量常用来衡量消毒剂的消毒能力,用 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
①称取含氯消毒片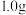 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用___________ 加蒸馏水至刻度线;
②配置 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入___________ 色试剂瓶中,置于暗处放置7~14天后,用酸性 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;
③用滴定管量取 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入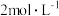 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至___________ 即为终点。记录消耗的 溶液的体积;
溶液的体积;
④重复上述操作三次。四次测定的数据如下表:
根据 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知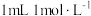 的硫代硫酸钠相当于
的硫代硫酸钠相当于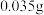 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为___________ %。
 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为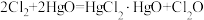 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①
 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;②
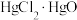 是难溶于水的固体。
是难溶于水的固体。(1)仪器a的名称是
(2)装置B的作用是
(3)D中通入
 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为(4)有效含氯量常用来衡量消毒剂的消毒能力,用
 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:①称取含氯消毒片
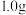 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用②配置
 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;③用滴定管量取
 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入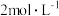 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至 溶液的体积;
溶液的体积;④重复上述操作三次。四次测定的数据如下表:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/ 溶液的体积/ | 20.05 | 20.00 | 19.95 | 20.45 |
 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知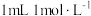 的硫代硫酸钠相当于
的硫代硫酸钠相当于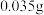 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为
您最近一年使用:0次
解题方法
8 . 工业上常用软锰矿(主要成分 )为原料制备高锰酸钾。
)为原料制备高锰酸钾。
(1)将软锰矿和KOH固体粉碎后混合,鼓入空气充分焙烧,冷却后,将固体研细,用碱性溶液浸取,过滤得 溶液。再采用惰性电极阳离子交换膜法电解
溶液。再采用惰性电极阳离子交换膜法电解 溶液(装置如图所示),制得
溶液(装置如图所示),制得 。
。
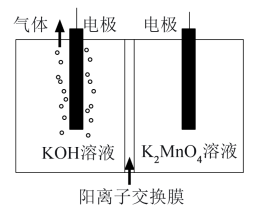
①原料经焙烧生成 ,焙烧时空气的作用是
,焙烧时空气的作用是___________ 。
②电解时,阳极的电极反应式为___________ 。
③研究发现,当未使用阳离子交换膜进行电解时, 的产率降低,其原因是
的产率降低,其原因是___________ 。
(2)测定 产品的纯度。
产品的纯度。
称取2.5000g样品溶于水,加入硫酸酸化后配成100.00mL溶液,取20.00mL置于锥形瓶中,用 标准
标准 溶液进行滴定。(反应原理为
溶液进行滴定。(反应原理为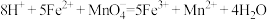 )
)
①滴定终点的现象是___________ 。
②记录实验消耗 溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时
溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时___________ (填字母)。
A.装液前,滴定管没有用标准液润洗
B.洗涤后,锥形瓶未干燥直接加入待测的 溶液
溶液
C.滴定前滴定管中尖嘴处有气泡,滴定结束后气泡消失
③数据处理。将后两次实验消耗 溶液体积取平均值为30.00mL。计算该
溶液体积取平均值为30.00mL。计算该 产品的质量分数
产品的质量分数___________ (写出计算过程)。
 )为原料制备高锰酸钾。
)为原料制备高锰酸钾。(1)将软锰矿和KOH固体粉碎后混合,鼓入空气充分焙烧,冷却后,将固体研细,用碱性溶液浸取,过滤得
 溶液。再采用惰性电极阳离子交换膜法电解
溶液。再采用惰性电极阳离子交换膜法电解 溶液(装置如图所示),制得
溶液(装置如图所示),制得 。
。
①原料经焙烧生成
 ,焙烧时空气的作用是
,焙烧时空气的作用是②电解时,阳极的电极反应式为
③研究发现,当未使用阳离子交换膜进行电解时,
 的产率降低,其原因是
的产率降低,其原因是(2)测定
 产品的纯度。
产品的纯度。称取2.5000g样品溶于水,加入硫酸酸化后配成100.00mL溶液,取20.00mL置于锥形瓶中,用
 标准
标准 溶液进行滴定。(反应原理为
溶液进行滴定。(反应原理为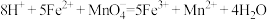 )
)①滴定终点的现象是
②记录实验消耗
 溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时
溶液的体积。第一次实验的记录数据明显大于后两次,其原因可能是第一次滴定时A.装液前,滴定管没有用标准液润洗
B.洗涤后,锥形瓶未干燥直接加入待测的
 溶液
溶液C.滴定前滴定管中尖嘴处有气泡,滴定结束后气泡消失
③数据处理。将后两次实验消耗
 溶液体积取平均值为30.00mL。计算该
溶液体积取平均值为30.00mL。计算该 产品的质量分数
产品的质量分数
您最近一年使用:0次
名校
解题方法
9 . 芳香化合物在一定条件下可与卤代烃发生取代反应。某科研小组以苯、ClCCH3)3为反应物,无水AlCl3为催化剂,制备 (叔丁基苯)。反应原理如下:
(叔丁基苯)。反应原理如下:
 +ClC(CH3)3
+ClC(CH3)3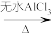
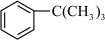 +HCl
+HCl
已知:
I.实验室模拟制备无水AlCl3的实验装置如图I所示:
(1)写出装置A中发生反应的化学方程式:_____________ 。
(2)装置B中的试剂为_____________ ;加热顺序:应先点燃________ (填“A”或“D”)处酒精灯。
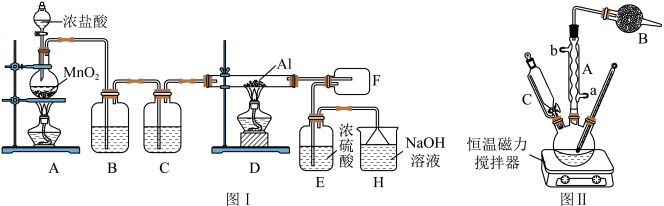
Ⅱ.实验室制取叔丁基苯的装置如图II所示:
①将35mL苯和足量的无水AlCl3加入三颈烧瓶中;
②滴加氯代叔丁烷[ClC(CH3)3]10mL;
③打开恒温磁力搅拌器反应一段时间;
④洗涤,将反应后的混合物依次用稀盐酸、Na2CO3溶液、H2O洗涤分离;
⑤在所得产物中加入少量无水MgSO4固体、静置,过滤,蒸馏;
⑥称量,得到叔丁基苯10.0g。
(1)用稀盐酸洗涤的目的是________________ ,“洗涤”后“分离”的操作名称是________ 。
(2)加无水MgSO4固体的作用是__________ ,蒸馏时为得到较为纯净的叔丁基苯,应选取蒸气温度在___________ 摄氏度左右的馏分。
(3)叔丁基苯的产率为___________ %(保留至小数点后1位)。
(4)叔丁基苯可以通过一系列反应制备对叔丁基苯甲酸和对叔丁基苯甲酸甲酯,二者均在工业上有重要用途。
①若要分离出未反应完的叔丁基苯进行回收利用(其中含有少量对叔丁基苯甲酸),可选用的实验方案为__________ 。
a.水;分液b.CCl4;蒸馏c.NaOH溶液;蒸馏d.NaOH溶液;分液
②对叔丁基苯甲酸甲酯广泛用于制化妆品、药品,请写出对叔丁基苯甲酸与甲醇反应制备对叔丁基苯甲酸甲酯的化学方程式____________________________________ 。
 (叔丁基苯)。反应原理如下:
(叔丁基苯)。反应原理如下: +ClC(CH3)3
+ClC(CH3)3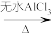
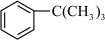 +HCl
+HCl已知:
相对分子质量 | 密度/g·cm–3 | 沸点/℃ | 溶解性 | |
AlCl3 | 133.5 | 2.41 | 181 | 极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88 | 80.1 | 难溶于水 |
ClC(CH3)3 | 92.5 | 0.85 | 51.6 | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 | 169 | 难溶于水,易溶于苯 |

(1)写出装置A中发生反应的化学方程式:
(2)装置B中的试剂为
Ⅱ.实验室制取叔丁基苯的装置如图II所示:
①将35mL苯和足量的无水AlCl3加入三颈烧瓶中;
②滴加氯代叔丁烷[ClC(CH3)3]10mL;
③打开恒温磁力搅拌器反应一段时间;
④洗涤,将反应后的混合物依次用稀盐酸、Na2CO3溶液、H2O洗涤分离;
⑤在所得产物中加入少量无水MgSO4固体、静置,过滤,蒸馏;
⑥称量,得到叔丁基苯10.0g。
(1)用稀盐酸洗涤的目的是
(2)加无水MgSO4固体的作用是
(3)叔丁基苯的产率为
(4)叔丁基苯可以通过一系列反应制备对叔丁基苯甲酸和对叔丁基苯甲酸甲酯,二者均在工业上有重要用途。
①若要分离出未反应完的叔丁基苯进行回收利用(其中含有少量对叔丁基苯甲酸),可选用的实验方案为
a.水;分液b.CCl4;蒸馏c.NaOH溶液;蒸馏d.NaOH溶液;分液
②对叔丁基苯甲酸甲酯广泛用于制化妆品、药品,请写出对叔丁基苯甲酸与甲醇反应制备对叔丁基苯甲酸甲酯的化学方程式
您最近一年使用:0次



