名校
解题方法
1 . 化学反应中伴随着能量变化,请按要求回答下面的问题。
(1)下列反应中,生成物总能量大于反应物总能量的是______ (填序号)
①酸与碱的中和反应 ②碳酸氢钠和盐酸反应 ③镁和盐酸反应 ④碳与二氧化碳反应 ⑤ 晶体与
晶体与 混合搅拌
混合搅拌
(2)汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,如图是
等污染大气,如图是 和
和 反应生成
反应生成 的能量变化,则图中三种分子最稳定的是
的能量变化,则图中三种分子最稳定的是______ (写分子式)。若反应生成 气体,则
气体,则______ (填“吸收”或“放出”)______  的热量。
的热量。
根据实验现象回答:四种金属活泼性由强到弱的顺序是______ 。
(4)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池,放电时的电池总反应为
该铅蓄电池负极材料是______ ,写出放电时正极的电极反应式______ 。
(5)为了验泟 与
与 氧化性强弱,下列装置能达到实验目的的是
氧化性强弱,下列装置能达到实验目的的是______ (写序号),写出其正极的电极反应式______ 。若开始时两极质量相等,当导线中通过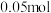 电子时,两个电极的质量差为
电子时,两个电极的质量差为______ 克。
(1)下列反应中,生成物总能量大于反应物总能量的是
①酸与碱的中和反应 ②碳酸氢钠和盐酸反应 ③镁和盐酸反应 ④碳与二氧化碳反应 ⑤
 晶体与
晶体与 混合搅拌
混合搅拌(2)汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,如图是
等污染大气,如图是 和
和 反应生成
反应生成 的能量变化,则图中三种分子最稳定的是
的能量变化,则图中三种分子最稳定的是 气体,则
气体,则 的热量。
的热量。
| 装置 |
|
|
|
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(4)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池,放电时的电池总反应为

该铅蓄电池负极材料是
(5)为了验泟
 与
与 氧化性强弱,下列装置能达到实验目的的是
氧化性强弱,下列装置能达到实验目的的是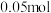 电子时,两个电极的质量差为
电子时,两个电极的质量差为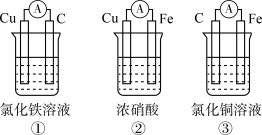
您最近一年使用:0次
解题方法
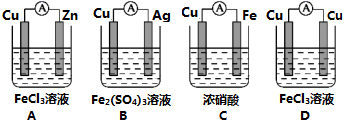
2 . I.原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
(1)装置甲中 向
向___________ 极移动(填“A”或“B”);
(2)四种金属活动性由强到弱的顺序是___________ ;
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为___________ mol。
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的___________ 极,X极的电极反应方程式为___________ ,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是___________ L。
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是___________ 。
(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是___________ (填物质化学式),该电极质量___________ (填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到___________ mol/L。
| 装置 | 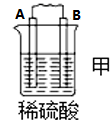 | 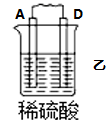 | 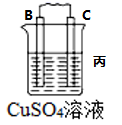 |
| 现象 | B上有气体产生 | D不断溶解 | C质量增加 |
(1)装置甲中
 向
向(2)四种金属活动性由强到弱的顺序是
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
您最近一年使用:0次
名校
解题方法
3 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
588次组卷
|
4卷引用:重庆市南坪中学2020-2021学年高一上学期期中考试化学试题
重庆市南坪中学2020-2021学年高一上学期期中考试化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题
4 . 某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
①甲同学设计实验的目的是验证:同一主族,从上到下金属元素的原子失电子能力逐渐增强;同一周期,从左到右金属元素的原子失电子能力逐渐___________________ ;
②反应最剧烈的烧杯中金属是_______ (填字母序号);
A.钠 B.镁 C.铝 D.钾
③写出a烧杯中发生反应的离子方程式______________________________ ;
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_________ (填字母序号)。
A.把镁、铝的金属块换成金属粉末 B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸 D.把烧杯中的冷水换成氢氧化钠溶液
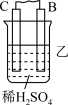
(2)乙同学设计实验验证:非金属元素原子得电子能力越强,其最高价含氧酸的酸性就越强。他设计了如图装置以验证碳、氮、硅元素的原子的电子能力的强弱。乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;烧杯中盛放C的溶液。打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成。

①写出所选用物质的化学式:A________ 、 C________ ;
②写出烧瓶中发生反应的化学方程式:__________________________________ ;
③写出烧杯中发生反应的化学方程式:__________________________________ ;
④碳、氮、硅元素原子得电子能力强弱顺序为_____________________________ 。
(1)甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
①甲同学设计实验的目的是验证:同一主族,从上到下金属元素的原子失电子能力逐渐增强;同一周期,从左到右金属元素的原子失电子能力逐渐
②反应最剧烈的烧杯中金属是
A.钠 B.镁 C.铝 D.钾
③写出a烧杯中发生反应的离子方程式
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法
A.把镁、铝的金属块换成金属粉末 B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸 D.把烧杯中的冷水换成氢氧化钠溶液
(2)乙同学设计实验验证:非金属元素原子得电子能力越强,其最高价含氧酸的酸性就越强。他设计了如图装置以验证碳、氮、硅元素的原子的电子能力的强弱。乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;烧杯中盛放C的溶液。打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成。

①写出所选用物质的化学式:A
②写出烧瓶中发生反应的化学方程式:
③写出烧杯中发生反应的化学方程式:
④碳、氮、硅元素原子得电子能力强弱顺序为
您最近一年使用:0次
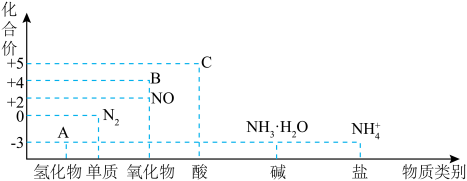
5 . 氮元素化合价一物质类别关系图如下。回答下列问题: 与
与 制取物质A,该反应的化学方程式为
制取物质A,该反应的化学方程式为____________________ 。
(2)若物质B为 ,实验室制备
,实验室制备 不能用排水法收集的原因是
不能用排水法收集的原因是____________________ (用化学方程式表示)。
(3)铜和足量的C的稀溶液反应,当生成 (标准状况)气体时,转移电子的物质的量为
(标准状况)气体时,转移电子的物质的量为__________  。
。
(4)实验室中,检验铵盐溶液中铵根离子的实验操作和现象是____________________ 。
(5)氨氮废水的处理是当前科学研究的热点问题。氨氮废水中的氨元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图所示:
的形式存在。某工厂处理氨氮废水的流程如图所示: 溶液的同时还需要鼓入大量空气,目的是
溶液的同时还需要鼓入大量空气,目的是____________________ 。
②含余氯废水的主要成分是 以及
以及 ,a可选用
,a可选用__________ (填序号)。
A. B.
B. C.
C. D.
D.
(6)上述处理过程逸出的 可用
可用 还原生成
还原生成 ,某同学在实验室中对该反应进行了探究。将上述收集到的
,某同学在实验室中对该反应进行了探究。将上述收集到的 经纯化后充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入
经纯化后充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入 (两端用夹子
(两端用夹子 、
、 夹好)。在一定温度下按图示装置进行实验。
夹好)。在一定温度下按图示装置进行实验。
 与
与 制取物质A,该反应的化学方程式为
制取物质A,该反应的化学方程式为(2)若物质B为
 ,实验室制备
,实验室制备 不能用排水法收集的原因是
不能用排水法收集的原因是(3)铜和足量的C的稀溶液反应,当生成
 (标准状况)气体时,转移电子的物质的量为
(标准状况)气体时,转移电子的物质的量为 。
。(4)实验室中,检验铵盐溶液中铵根离子的实验操作和现象是
(5)氨氮废水的处理是当前科学研究的热点问题。氨氮废水中的氨元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图所示:
的形式存在。某工厂处理氨氮废水的流程如图所示: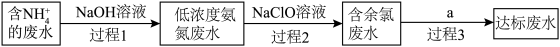
 溶液的同时还需要鼓入大量空气,目的是
溶液的同时还需要鼓入大量空气,目的是②含余氯废水的主要成分是
 以及
以及 ,a可选用
,a可选用A.
 B.
B. C.
C. D.
D.
(6)上述处理过程逸出的
 可用
可用 还原生成
还原生成 ,某同学在实验室中对该反应进行了探究。将上述收集到的
,某同学在实验室中对该反应进行了探究。将上述收集到的 经纯化后充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入
经纯化后充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入 (两端用夹子
(两端用夹子 、
、 夹好)。在一定温度下按图示装置进行实验。
夹好)。在一定温度下按图示装置进行实验。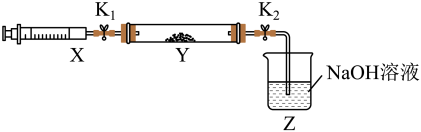
操作步骤 | 实验现象 | 解释原因 |
打开 ,推动注射器活塞,使X中的气体缓慢充入Y管中 ,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中 | ②反应的化学方程式: |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开 | Z中 溶液产生倒吸现象 溶液产生倒吸现象 | ③ |
您最近一年使用:0次
解题方法
6 . 草酸亚铁晶体 ,黄色,难溶于水,可溶于稀
,黄色,难溶于水,可溶于稀 ,有较强还原性。某化学兴趣小组用下列装置制备草酸亚铁晶体并检测其纯度。
,有较强还原性。某化学兴趣小组用下列装置制备草酸亚铁晶体并检测其纯度。 。实验步骤如下:
。实验步骤如下:
第一步:按图连接好装置,检查装置气密性,
第二步:打开______,关闭______(填 或
或 )开始反应,
)开始反应,
第三步:……
第四步:打开 ,关闭
,关闭 ,使
,使 中溶液进入到
中溶液进入到 中反应,
中反应,
第五步:对B中所得溶液蒸发浓缩,冷却结晶,过滤,洗涤和干燥可得 。
。
请回答下列问题:
(1)请把实验步骤补充完整.
第二步:打开______ ,关闭______ (填 或
或 ;
;
第三步:______ 。
(2)装置 的作用是
的作用是______ 。
II.样品纯度检测
该方法制得的 中可能含有
中可能含有 杂质。
杂质。
(3)写出生成 的化学反应方程式
的化学反应方程式______ 。
采用 滴定法滴定该样品的纯度,步骤如下:
滴定法滴定该样品的纯度,步骤如下:
①取ag样品于锥形瓶中,加入稀 溶解,水浴加热至
溶解,水浴加热至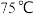 ,用
,用 的
的 溶液趁热滴定至终点,消耗
溶液趁热滴定至终点,消耗 溶液
溶液 。
。
②向上述溶液中加入适量还原剂将 全部还原成
全部还原成 ,加入稀
,加入稀 酸化后,在
酸化后,在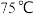 继续用该
继续用该 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
(4)步骤①中,滴定终点的现象为______ 。
(5)样品中 的质量分数
的质量分数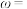
______  。
。
(6)当 和
和 满足
满足______ 关系时,样品中不含 。
。
 ,黄色,难溶于水,可溶于稀
,黄色,难溶于水,可溶于稀 ,有较强还原性。某化学兴趣小组用下列装置制备草酸亚铁晶体并检测其纯度。
,有较强还原性。某化学兴趣小组用下列装置制备草酸亚铁晶体并检测其纯度。
 。实验步骤如下:
。实验步骤如下:第一步:按图连接好装置,检查装置气密性,
第二步:打开______,关闭______(填
 或
或 )开始反应,
)开始反应,第三步:……
第四步:打开
 ,关闭
,关闭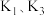 ,使
,使 中溶液进入到
中溶液进入到 中反应,
中反应,第五步:对B中所得溶液蒸发浓缩,冷却结晶,过滤,洗涤和干燥可得
 。
。请回答下列问题:
(1)请把实验步骤补充完整.
第二步:打开
 或
或 ;
;第三步:
(2)装置
 的作用是
的作用是II.样品纯度检测
该方法制得的
 中可能含有
中可能含有 杂质。
杂质。(3)写出生成
 的化学反应方程式
的化学反应方程式采用
 滴定法滴定该样品的纯度,步骤如下:
滴定法滴定该样品的纯度,步骤如下:①取ag样品于锥形瓶中,加入稀
 溶解,水浴加热至
溶解,水浴加热至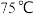 ,用
,用 的
的 溶液趁热滴定至终点,消耗
溶液趁热滴定至终点,消耗 溶液
溶液 。
。②向上述溶液中加入适量还原剂将
 全部还原成
全部还原成 ,加入稀
,加入稀 酸化后,在
酸化后,在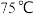 继续用该
继续用该 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。(4)步骤①中,滴定终点的现象为
(5)样品中
 的质量分数
的质量分数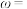
 。
。(6)当
 和
和 满足
满足 。
。
您最近一年使用:0次
2024高三下·全国·专题练习
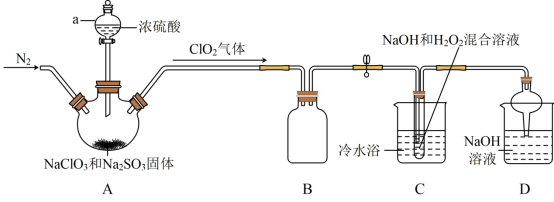
7 . 二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如图装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2 =
=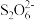 +2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现
+2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现_______ (填实验现象),达到滴定终点,共消耗该标准溶液25.00mL,经计算该试样中NaClO2·3H2O的百分含量为_______ (结果保留3位有效数字)。
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2
 =
=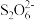 +2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现
+2I-)取样品0.6000g于锥形瓶中,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,然后用0.5000mol·L-1Na2S2O3标准溶液滴定,当出现
您最近一年使用:0次
8 . 磷酸氢二铵[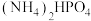 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备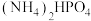 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。
(1)装置中活塞 的作用为
的作用为_______ 。实验过程中,当出现_______ 现象时,应及时关闭 ,打开
,打开 。
。
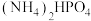 ]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备
]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备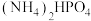 ,装置如图所示(夹持和搅拌装置已省略)。
,装置如图所示(夹持和搅拌装置已省略)。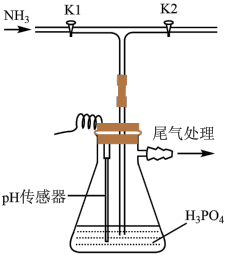
(1)装置中活塞
 的作用为
的作用为 ,打开
,打开 。
。
您最近一年使用:0次
9 . 物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据图正确回答下列含硫物质有关问题。
(1)a对应物质的类别是___________ ;
(2)图中 b、c、d 这三种物质中属于弱电解质的是_______________ (填化学式)。
(3)欲制备Na2S2O3(硫代硫酸钠),根据价类二维图信息分析,合理的是_______。
(4)请结合SO2类别、价态及特性,在如下图实验装置分析SO2的性质(经检验,装置的气密性良好)。
①是检验SO2的___________ 。
②中的现象褪色,体现了SO2的___________ 。
③中产生淡黄色浑浊,体现了SO2的___________ 。
(5)通入足量SO2后④中无明显现象,将其分成两份分别加入下列物质后均产生白色沉淀。
产生沉淀的化学式是:①___________ ,②___________ 。
(6)写出SO2与氢氧化钠溶液反应的化学方程式______________ 。
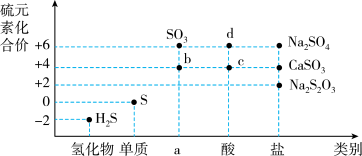
(1)a对应物质的类别是
(2)图中 b、c、d 这三种物质中属于弱电解质的是
(3)欲制备Na2S2O3(硫代硫酸钠),根据价类二维图信息分析,合理的是_______。
| A.Na2S+S | B.Na2SO3+S |
| C.Na2SO3+Na2SO4 | D.SO2+Na2SO4 |
(4)请结合SO2类别、价态及特性,在如下图实验装置分析SO2的性质(经检验,装置的气密性良好)。

①是检验SO2的
②中的现象褪色,体现了SO2的
③中产生淡黄色浑浊,体现了SO2的
(5)通入足量SO2后④中无明显现象,将其分成两份分别加入下列物质后均产生白色沉淀。
| 加入的物质 | H2O2 | 氨水 |
| 沉淀的化学式 | ① | ② |
(6)写出SO2与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
名校
解题方法
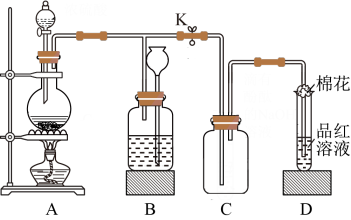
10 . 某化学课外兴趣小组用如图所示装置进行实验,制备某气体并验证其性质。请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②实验中,取一定质量的铜片和一定体积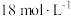 的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
A.有一定量的余酸但未能使铜片完全溶解,你认为原因是___________ 。
B.下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________ (填标号)。
a.铁粉 b. 溶液 c.银粉 d.
溶液 c.银粉 d. 溶液
溶液
(2)若装置A中分液漏斗盛装浓硫酸,圆底烧瓶盛装木炭。
①装置A中发生反应的化学方程式为___________ 。
②设计实验证明装置C中含有 时,所需的试剂有
时,所需的试剂有___________ (填标号)。
a. 溶液 b.澄清石灰水 c.品红溶液 d.酸性
溶液 b.澄清石灰水 c.品红溶液 d.酸性 溶液
溶液
(3)若装置A中分液漏斗盛装浓盐酸,圆底烧瓶盛装 粉末。
粉末。
①装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________ 。
②D中品红溶液褪色,加热试管里已褪色溶液时的现象为___________ 。
(4)装置D中试管口放置的棉花中浸了一种液体,可适用于(1)(2)(3)小题中实验,该液体是___________ 。
①装置A中发生反应的化学方程式为
②实验中,取一定质量的铜片和一定体积
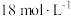 的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
的浓硫酸在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。A.有一定量的余酸但未能使铜片完全溶解,你认为原因是
B.下列药品中能用来证明反应结束后的烧瓶中确有余酸的是
a.铁粉 b.
 溶液 c.银粉 d.
溶液 c.银粉 d. 溶液
溶液(2)若装置A中分液漏斗盛装浓硫酸,圆底烧瓶盛装木炭。
①装置A中发生反应的化学方程式为
②设计实验证明装置C中含有
 时,所需的试剂有
时,所需的试剂有a.
 溶液 b.澄清石灰水 c.品红溶液 d.酸性
溶液 b.澄清石灰水 c.品红溶液 d.酸性 溶液
溶液(3)若装置A中分液漏斗盛装浓盐酸,圆底烧瓶盛装
 粉末。
粉末。①装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭止水夹K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
②D中品红溶液褪色,加热试管里已褪色溶液时的现象为
(4)装置D中试管口放置的棉花中浸了一种液体,可适用于(1)(2)(3)小题中实验,该液体是
您最近一年使用:0次
2024-03-13更新
|
410次组卷
|
4卷引用:贵州省盘州市第七中学2023-2024学年高三上学期12月考试化学试卷