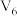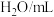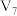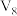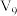名校
解题方法
1 .  是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
(1)常温下可用空气直接氧化脱除: ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
___________ 。
(2)电化学溶解-沉淀法回收利用 的工艺原理如图所示:
的工艺原理如图所示:
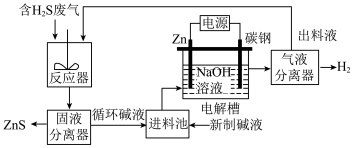
已知:Zn能与强碱溶液反应产生 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。
①锌棒连接直流电源的___________ (填“正极”或“负极”)。
②“反应器”中反应的离子方程式为___________ 。
③“电解槽”中没接通电源时已经有 产生,用化学用语解释原因
产生,用化学用语解释原因___________ ;
(3)间接电解法脱硫过程的装置图如图所示:
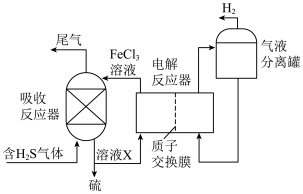
①溶液X的主要溶质是___________ 。
②简述在电解反应器中 溶液再生的原理:
溶液再生的原理:___________ 。
③不考虑其他副反应,理论上5mol 反应能生成
反应能生成___________  。
。
 是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。(1)常温下可用空气直接氧化脱除:
 ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
(2)电化学溶解-沉淀法回收利用
 的工艺原理如图所示:
的工艺原理如图所示:
已知:Zn能与强碱溶液反应产生
 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。①锌棒连接直流电源的
②“反应器”中反应的离子方程式为
③“电解槽”中没接通电源时已经有
 产生,用化学用语解释原因
产生,用化学用语解释原因(3)间接电解法脱硫过程的装置图如图所示:

①溶液X的主要溶质是
②简述在电解反应器中
 溶液再生的原理:
溶液再生的原理:③不考虑其他副反应,理论上5mol
 反应能生成
反应能生成 。
。
您最近一年使用:0次
2 . 实验室将无水酒精和浓硫酸(体积比为 )混合加热制乙烯气体。某学习小组设计了如图所示装置用于制取乙烯气体并验证乙烯的性质。请回答下列问题:
)混合加热制乙烯气体。某学习小组设计了如图所示装置用于制取乙烯气体并验证乙烯的性质。请回答下列问题:

(1)A装置的混合溶液里放入几片碎瓷片,作用是_______ 。
(2)此实验可验证乙烯的性质是_______ ,C装置中的现象是_______ 。
(3)B装置中 溶液的作用是
溶液的作用是_______ 。
(4)写出生成乙烯的化学反应方程式:_______ 。
(5)有同学提出,利用溴水替代 和酸性高锰酸钾溶液,同样可以验证乙烯是不饱和烃,请你利用化学方程式说明该方案的不合理性:
和酸性高锰酸钾溶液,同样可以验证乙烯是不饱和烃,请你利用化学方程式说明该方案的不合理性:_______ 。
 )混合加热制乙烯气体。某学习小组设计了如图所示装置用于制取乙烯气体并验证乙烯的性质。请回答下列问题:
)混合加热制乙烯气体。某学习小组设计了如图所示装置用于制取乙烯气体并验证乙烯的性质。请回答下列问题:
(1)A装置的混合溶液里放入几片碎瓷片,作用是
(2)此实验可验证乙烯的性质是
(3)B装置中
 溶液的作用是
溶液的作用是(4)写出生成乙烯的化学反应方程式:
(5)有同学提出,利用溴水替代
 和酸性高锰酸钾溶液,同样可以验证乙烯是不饱和烃,请你利用化学方程式说明该方案的不合理性:
和酸性高锰酸钾溶液,同样可以验证乙烯是不饱和烃,请你利用化学方程式说明该方案的不合理性:
您最近一年使用:0次
解题方法
3 . Ⅰ. 全钒液流电池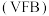 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为 放电工作原理。
放电工作原理。
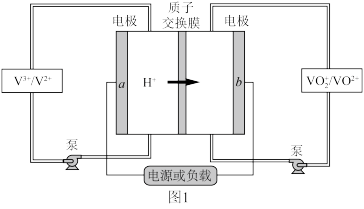
(1)电极 为
为___________ 极(填“正”或“负”),充电时, 电极的反应为
电极的反应为___________ 。
(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
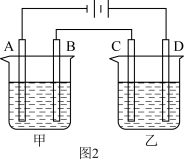
①甲槽是电极电解饱和食盐水的装置,产生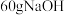 时,
时, 电池中消耗
电池中消耗___________  。
。
②乙槽为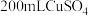 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为___________  。
。
③若通电一段时间后,向所得的乙槽溶液中加入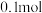 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为___________ (用 表示)。
表示)。
Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有 ,其中
,其中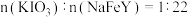 (其中
(其中 显
显 价);
价);
② 。
。
实验步骤:称取 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用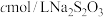 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。
(3)滴定终点的现象为___________ 。
(4)样品中铁元素的质量分数为___________ 。
 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为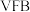 放电工作原理。
放电工作原理。
(1)电极
 为
为 电极的反应为
电极的反应为(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生
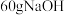 时,
时,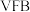 电池中消耗
电池中消耗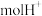 。
。②乙槽为
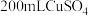 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为 。
。③若通电一段时间后,向所得的乙槽溶液中加入
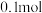 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为 表示)。
表示)。Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有
 ,其中
,其中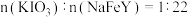 (其中
(其中 显
显 价);
价);②
 。
。实验步骤:称取
 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用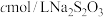 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。(3)滴定终点的现象为
(4)样品中铁元素的质量分数为
您最近一年使用:0次
名校
4 . 。部分实验中涉及到的物质的熔沸点如表所示。
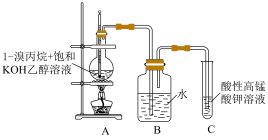
完成下列填空:
(1)写出1-溴丙烷制备丙烯的化学方程式___________ 。
(2)A装置中的导气管较长,可以起到使反应物________ 的作用。若导管的长度太长,C中酸性高锰酸钾溶液褪色时间会延后,可能的原因是________ 。B装置是洗气装置,可以除去从A中导出气体中的杂质_________ 、_______ 。
(3)该实验小组查阅了相关资料后发现,1-溴丙烷制备丙烯的反应需要在65℃以上才能发生。为了更好地达到控温的效果,可以采取_____ 的方式进行加热,这种加热方式除了方便控温外这还具有______ 的优势。加热时将温度控制在65-70℃之间,请结合表中数据阐释选择该温度范围的原因___________ 。
(4)溶液的碱性越强,该反应越容易发生。NaOH与KOH都是常见的水溶液中的强碱,但是经实验测定NaOH在乙醇中的碱性弱于KOH在乙醇中的碱性,这是因为根据元素周期律,Na的______ (选填“金属性”或“非金属性”)______ (选填“强于”或“弱于”)K。结合题目及题干信息,阐释实验采用饱和的KOH乙醇溶液而不采用饱和的NaOH乙醇溶液的原因___________ 。
(5)可以采用溴的四氯化碳溶液吸收生成的丙烯,写出溴的四氯化碳溶液与丙烯反应的化学方程式_______ 。若反应前量取了9.1mL的1-溴丙烷,充分反应后溴的四氯化碳溶液质量增加了0.336g,则丙烯的产率为______ ,请提出一个产率偏低的可能原因___________ 。
| 熔点(℃) | 沸点(℃) | 密度(g·ml-1) | |
| 1-溴丙烷 | -110 | 71 | 1.354 |
| 乙醇 | -114 | 78 | 0.79 |
| 丙烯 | -185 | -47 | |
| NaBr | 755 | 1390 | |
| 饱和KOH乙醇溶液 | 116 | ||
| 饱和NaOH乙醇溶液 | 85 |

完成下列填空:
(1)写出1-溴丙烷制备丙烯的化学方程式
(2)A装置中的导气管较长,可以起到使反应物
(3)该实验小组查阅了相关资料后发现,1-溴丙烷制备丙烯的反应需要在65℃以上才能发生。为了更好地达到控温的效果,可以采取
(4)溶液的碱性越强,该反应越容易发生。NaOH与KOH都是常见的水溶液中的强碱,但是经实验测定NaOH在乙醇中的碱性弱于KOH在乙醇中的碱性,这是因为根据元素周期律,Na的
(5)可以采用溴的四氯化碳溶液吸收生成的丙烯,写出溴的四氯化碳溶液与丙烯反应的化学方程式
您最近一年使用:0次
名校
解题方法
5 . 1,2,3-三溴苯是一种重要的化工原料,合成1,2,3-三溴苯的流程图如下图所示:
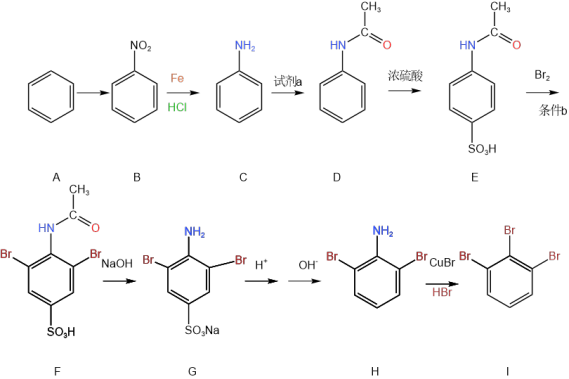
(1)由A生成B的化学方程式为___________ ,由E生成F的条件b为___________ ,由B生成C的反应类型为___________ 。
(2)试剂a的结构简式为 ,由C生成D反应类型为取代反应,则C生成D的化学方程式为
,由C生成D反应类型为取代反应,则C生成D的化学方程式为___________ 。浓硫酸可以和苯发生取代反应,反应中将硫酸视作 HO—SO3H,请写出由D生成E的化学方程式 ___________ 。
(3)由F到G主要经历了反应(i)、反应(ii)和反应(iii)三个过程,其中反应(i)为可逆反应,请结合平衡移动原理分析NaOH在F转变为G的过程中起到的作用__________ 。
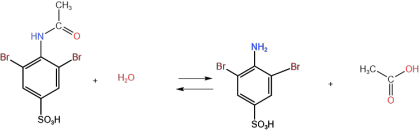 (i)
(i)
 (ii)
(ii)
CH3COOH+NaOH=CH3COONa+H2O(iii)
加入NaOH溶液后苯环上的溴原子没有发生水解反应,而溴乙烷在NaOH的水溶液中会发生水解反应,这说明与苯环相连的碳溴键键能_____ (填“大于”、“小于”或“等于”)与烷基相连的碳溴键键能。
(4)苯环上原有的取代基能够影响新进入的取代基的取代位置,这种效应称为取代基定位效应。如苯环上存在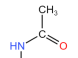 取代基时,取代反应中新取代基主要进入该取代基的邻位和对位,且对位产物的产率高于邻位产物;苯环上存在磺酸基(−SO3H)时新取代基主要进入其间位。请结合取代基的定位效应分析流程中E→H过程中首先取代−SO3H再加入H+使其离去过程的意义
取代基时,取代反应中新取代基主要进入该取代基的邻位和对位,且对位产物的产率高于邻位产物;苯环上存在磺酸基(−SO3H)时新取代基主要进入其间位。请结合取代基的定位效应分析流程中E→H过程中首先取代−SO3H再加入H+使其离去过程的意义___________ 。
(5)卤原子是邻、对位定位基(对位产物为主要产物),硝基(−NO2)是间位定位基。结合流程信息和定位基效应,设计由苯和其他必要无机试剂合成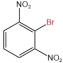 的合成路线
的合成路线_______ 。(合成路线常用的表示方式为:D E
E F)
F)

(1)由A生成B的化学方程式为
(2)试剂a的结构简式为
 ,由C生成D反应类型为取代反应,则C生成D的化学方程式为
,由C生成D反应类型为取代反应,则C生成D的化学方程式为(3)由F到G主要经历了反应(i)、反应(ii)和反应(iii)三个过程,其中反应(i)为可逆反应,请结合平衡移动原理分析NaOH在F转变为G的过程中起到的作用
 (i)
(i) (ii)
(ii)CH3COOH+NaOH=CH3COONa+H2O(iii)
加入NaOH溶液后苯环上的溴原子没有发生水解反应,而溴乙烷在NaOH的水溶液中会发生水解反应,这说明与苯环相连的碳溴键键能
(4)苯环上原有的取代基能够影响新进入的取代基的取代位置,这种效应称为取代基定位效应。如苯环上存在
 取代基时,取代反应中新取代基主要进入该取代基的邻位和对位,且对位产物的产率高于邻位产物;苯环上存在磺酸基(−SO3H)时新取代基主要进入其间位。请结合取代基的定位效应分析流程中E→H过程中首先取代−SO3H再加入H+使其离去过程的意义
取代基时,取代反应中新取代基主要进入该取代基的邻位和对位,且对位产物的产率高于邻位产物;苯环上存在磺酸基(−SO3H)时新取代基主要进入其间位。请结合取代基的定位效应分析流程中E→H过程中首先取代−SO3H再加入H+使其离去过程的意义(5)卤原子是邻、对位定位基(对位产物为主要产物),硝基(−NO2)是间位定位基。结合流程信息和定位基效应,设计由苯和其他必要无机试剂合成
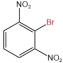 的合成路线
的合成路线 E
E F)
F)
您最近一年使用:0次
名校
6 . 回答下列问题
(1)纯水在 时,
时, ,在此温度下,将
,在此温度下,将 的氢氧化钠溶液
的氢氧化钠溶液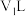 与
与 的硫酸溶液
的硫酸溶液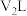 混合(设混合后溶液体积为原两溶液体积之和)所得溶液的
混合(设混合后溶液体积为原两溶液体积之和)所得溶液的 ,则
,则
___________ .
(2)若某溶液中只存在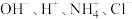 四种离子,且
四种离子,且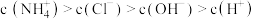 ,该溶液的溶质是
,该溶液的溶质是___________ .
(3)某同学在稀硫酸与锌反应制取氢气的实验中发现加入少量硫酸铜溶液可加快该反应中氢气的生成速率.为了进一步研究所加硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量 粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.
粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.
请完成此实验设计,其中
___________ ,
___________ .
(4)常温下,用 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 .若某次捕捉后得到
.若某次捕捉后得到 的溶液,则溶液中
的溶液,则溶液中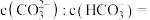
___________ [常温下,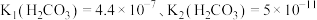 ].
].
(5)常温下,将 的醋酸与
的醋酸与 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在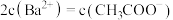 ,则该混合溶液中醋酸的电离常数
,则该混合溶液中醋酸的电离常数
___________ (用含a和b的代数式表示)
(1)纯水在
 时,
时, ,在此温度下,将
,在此温度下,将 的氢氧化钠溶液
的氢氧化钠溶液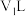 与
与 的硫酸溶液
的硫酸溶液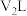 混合(设混合后溶液体积为原两溶液体积之和)所得溶液的
混合(设混合后溶液体积为原两溶液体积之和)所得溶液的 ,则
,则
(2)若某溶液中只存在
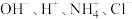 四种离子,且
四种离子,且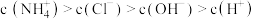 ,该溶液的溶质是
,该溶液的溶质是(3)某同学在稀硫酸与锌反应制取氢气的实验中发现加入少量硫酸铜溶液可加快该反应中氢气的生成速率.为了进一步研究所加硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量
 粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.
粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需的时间.混合溶液组成 | A | B | C | D | E | F |
| 30 |
|
|
|
|
|
饱和 | 0 | 0.5 | 2.5 | 5 |
| 20 |
|
|
|
|
| 10 | 0 |

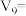
(4)常温下,用
 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 .若某次捕捉后得到
.若某次捕捉后得到 的溶液,则溶液中
的溶液,则溶液中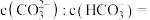
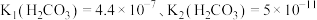 ].
].(5)常温下,将
 的醋酸与
的醋酸与 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在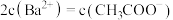 ,则该混合溶液中醋酸的电离常数
,则该混合溶液中醋酸的电离常数
您最近一年使用:0次
名校
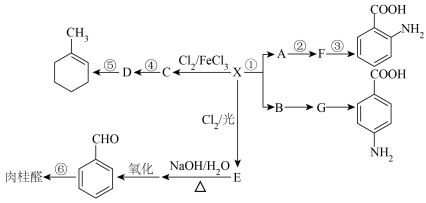
7 . 某芳香烃X是一种重要的有机化工原料,质谱法测定其相对分子质量为92,现以它为初始原料设计出如下转化关系图。期中C、E互为同分异构体,且相对分子质量比X大34.5;A、B互为同分异构体,分子式为C7H7NO2。
已知:Ⅰ.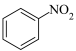
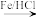
 (苯胺,易被氧化)
(苯胺,易被氧化)
Ⅱ.RCH2CHO+R′CHO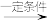
 +H2O
+H2O
(1)X的名称为___________ ,F的结构简式为___________ 。
(2)反应①的试剂条件为___________ ,反应③的类型为___________ 。
(3)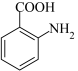 、
、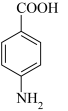 沸点较低的是
沸点较低的是___________ ,原因是___________ 。
(4)反应④两种反应物的物质的量之比为___________ 。
(5)反应⑤的方程式为___________ 。
(6)肉桂醛的结构简式为 ,请写出反应⑥的方程式
,请写出反应⑥的方程式___________ 。
(7)肉桂醛有多种同分异构体,符合下列三个条件的同分异构体共有___________ 种,写出其中核磁共振氢谱中有4个吸收峰的物质的结构简式___________ 。
①与FeCl3能发生显色反应 ②含碳碳三键 ③苯环上有两个取代基
(8)2-丁烯醛(CH3CH=CHCHO)广泛用于树脂生产和有机合成中。结合题中信息,以乙烯为原料,经过三步反应制得2-丁烯醛。CH2=CH2→M→N→CH3CH=CHCHO,写出中间产物M、N得结构简式。M___________ ;N___________ 。

已知:Ⅰ.

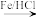
 (苯胺,易被氧化)
(苯胺,易被氧化)Ⅱ.RCH2CHO+R′CHO
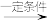
 +H2O
+H2O(1)X的名称为
(2)反应①的试剂条件为
(3)
 、
、 沸点较低的是
沸点较低的是(4)反应④两种反应物的物质的量之比为
(5)反应⑤的方程式为
(6)肉桂醛的结构简式为
 ,请写出反应⑥的方程式
,请写出反应⑥的方程式(7)肉桂醛有多种同分异构体,符合下列三个条件的同分异构体共有
①与FeCl3能发生显色反应 ②含碳碳三键 ③苯环上有两个取代基
(8)2-丁烯醛(CH3CH=CHCHO)广泛用于树脂生产和有机合成中。结合题中信息,以乙烯为原料,经过三步反应制得2-丁烯醛。CH2=CH2→M→N→CH3CH=CHCHO,写出中间产物M、N得结构简式。M
您最近一年使用:0次
8 . 生产生活中常见各类有机物,部分有机物的结构与用途如下:
(1)根据有机物的组成与结构,判断上述有机物中属于烃类的是___________ ,存在顺反异构的是___________ 。
(2)有机物①用作燃料时发生反应的化学方程式是___________ 。
(3)利用有机物②合成橡胶时的步骤如下:

①物质B的结构简式是___________ 。
②过程ii的试剂a是___________ 。
③过程ii的反应类型是___________ 反应。
(4)有机物③含有的官能团是___________ 。有机物③作为酸味剂发挥作用时,断裂的化学键是(在下图中标出) __________ 。

(5)有机物④合成蛋白质时,自身反应生成二肽的结构简式是:___________ 。
(6)已知葡萄糖在溶液中存在链式和环式两种结构,且存在如下平衡:
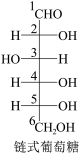

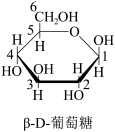
①β-D-葡萄糖是通过链式葡萄糖分子中___________ 和___________ (填官能团)通过___________ (填反应类型)反应而形成的。
②利用葡萄糖可以合成FDCA,用于制造树脂,其合成路线如下:
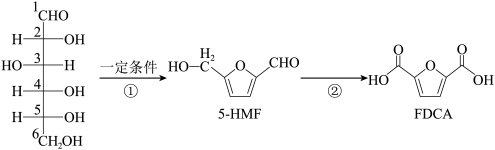
下列说法正确的是___________ 。
a.①中发生了取代反应和消去反应
b.反应①说明了葡萄糖分子中多羟基的性质
c.反应②可以由5-HMF与银氨溶液直接反应获得
d.FDCA的分子式为C6H4O5
| HC≡CH焊接金属的燃料 |  合成橡胶的基础原料 | CH3CH(OH)COOH食品常用的酸味剂 | 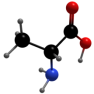 合成蛋白质原料 | 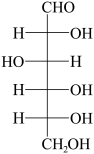 为机体供能,制造树脂 |
| ① | ② | ③ | ④ | ⑤ |
(1)根据有机物的组成与结构,判断上述有机物中属于烃类的是
(2)有机物①用作燃料时发生反应的化学方程式是
(3)利用有机物②合成橡胶时的步骤如下:

①物质B的结构简式是
②过程ii的试剂a是
③过程ii的反应类型是
(4)有机物③含有的官能团是

(5)有机物④合成蛋白质时,自身反应生成二肽的结构简式是:
(6)已知葡萄糖在溶液中存在链式和环式两种结构,且存在如下平衡:



①β-D-葡萄糖是通过链式葡萄糖分子中
②利用葡萄糖可以合成FDCA,用于制造树脂,其合成路线如下:

下列说法正确的是
a.①中发生了取代反应和消去反应
b.反应①说明了葡萄糖分子中多羟基的性质
c.反应②可以由5-HMF与银氨溶液直接反应获得
d.FDCA的分子式为C6H4O5
您最近一年使用:0次
名校
9 . 卤代烃是重要的工业原料,同时对环境造成严重影响,如破坏臭氧层等,请回答下列问题:
I.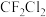 破坏臭氧层的机理为:
破坏臭氧层的机理为:
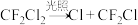
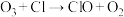

(1)活性氯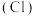 的作用是
的作用是___________ 。
(2)下列关于氟利昂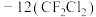 、氟利昂
、氟利昂 的推测错误的有
的推测错误的有___________ 。
A.两种氟利昂在 醇溶液中均可发生消去反应
醇溶液中均可发生消去反应
B.两种氟利昂均不存在同分异构体
C.直接用 溶液均可检验两种氟利昂中的氯元素
溶液均可检验两种氟利昂中的氯元素
II.Glaser反应是指端炔烃在催化剂存在下发生的偶联反应,例如: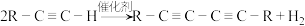 ,下面是以氯乙烷为原料利用Glaser反应制备化合物E的一种合成路线:
,下面是以氯乙烷为原料利用Glaser反应制备化合物E的一种合成路线:
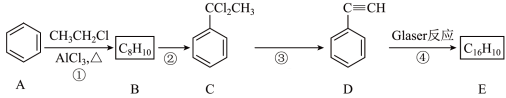
请回答下列问题:
(3)步骤①的反应类型为___________ ,步骤②的试剂和条件为___________ ,D的名称为___________ 。
(4)写出步骤③反应的化学方程式:___________ 。
(5)E的结构简式为___________ 。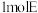 与
与 反应,理论上最多需要消耗
反应,理论上最多需要消耗
___________  。
。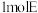 与溴水反应,理论上最多消耗
与溴水反应,理论上最多消耗
___________  。
。
(6)芳香族化合物F是C的同分异构体,其分子中只有两种氢原子,数目之比为 ,符合条件的F有5种,分别为
,符合条件的F有5种,分别为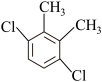
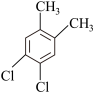
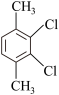
___________ 、___________ 。
(7)设计一条以环己醇(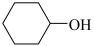 )为原料(其他无机试剂任取)合成
)为原料(其他无机试剂任取)合成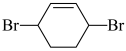 的合成路线
的合成路线_________ 。
(合成路线常用的表示方式为: )
)
I.
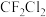 破坏臭氧层的机理为:
破坏臭氧层的机理为: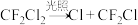
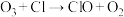

(1)活性氯
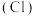 的作用是
的作用是(2)下列关于氟利昂
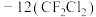 、氟利昂
、氟利昂 的推测错误的有
的推测错误的有A.两种氟利昂在
 醇溶液中均可发生消去反应
醇溶液中均可发生消去反应B.两种氟利昂均不存在同分异构体
C.直接用
 溶液均可检验两种氟利昂中的氯元素
溶液均可检验两种氟利昂中的氯元素II.Glaser反应是指端炔烃在催化剂存在下发生的偶联反应,例如:
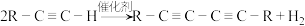 ,下面是以氯乙烷为原料利用Glaser反应制备化合物E的一种合成路线:
,下面是以氯乙烷为原料利用Glaser反应制备化合物E的一种合成路线:
请回答下列问题:
(3)步骤①的反应类型为
(4)写出步骤③反应的化学方程式:
(5)E的结构简式为
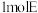 与
与 反应,理论上最多需要消耗
反应,理论上最多需要消耗
 。
。 与溴水反应,理论上最多消耗
与溴水反应,理论上最多消耗
 。
。(6)芳香族化合物F是C的同分异构体,其分子中只有两种氢原子,数目之比为
 ,符合条件的F有5种,分别为
,符合条件的F有5种,分别为


(7)设计一条以环己醇(
 )为原料(其他无机试剂任取)合成
)为原料(其他无机试剂任取)合成 的合成路线
的合成路线(合成路线常用的表示方式为:
 )
)
您最近一年使用:0次
名校
10 . 有机玻璃(聚甲基丙烯酸甲酯,结构见流程)用途广泛。一种合成路线如下:
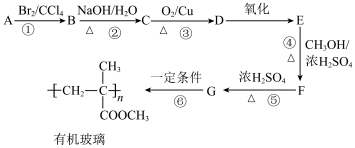
(1)已知原料A的分子式为C4H8,核磁共振氢谱中有两个吸收峰,并且面积比为1:3,则所属的物质类别为___________ 。
(2)写出流程中标有序号的六个反应中,属于取代反应的是___________ 。
(3)E中含有两种官能团,名称分别为___________ 。
(4)写出流程中反应的化学方程式②___________ ;③___________ 。
(5)G有多种同分异构体,写出期中一种链状的,含有-COOH且为顺式结构的同分异构体的结构简式___________ (写出一种即可)。

(1)已知原料A的分子式为C4H8,核磁共振氢谱中有两个吸收峰,并且面积比为1:3,则所属的物质类别为
(2)写出流程中标有序号的六个反应中,属于取代反应的是
(3)E中含有两种官能团,名称分别为
(4)写出流程中反应的化学方程式②
(5)G有多种同分异构体,写出期中一种链状的,含有-COOH且为顺式结构的同分异构体的结构简式
您最近一年使用:0次

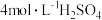 溶液/
溶液/




 溶液/
溶液/