解题方法
1 . 金属钛在医疗、航空、军工电子等领域使用非常广泛。以钛铁矿(主要成分为FeTiO3,还有Fe2O3、MgO、SiO2等杂质)为主要原料冶炼金属钛生产流程如图所示。
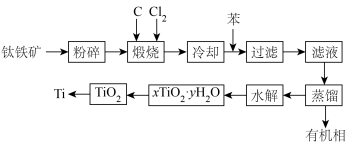
已知:
(1)煅烧过程中主要反应的化学方程式为___________ ,煅烧过程中发生的反应为吸热反应,该反应能够自发进行的原因是___________ 。
(2)“水解”发生的化学方程式为___________ 。
(3)在上述工艺流程中可以循环使用的物质是___________ 。
(4)测定产物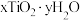 组成的方法如下:
组成的方法如下:
步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:
①步骤一中用稀硫酸而不用水定容的原因是___________ 。
②通过计算确定该样品的组成为___________ 。
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式___________ 。

已知:
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| TiCl4 | -25 | 136 | 溶于苯,遇水分解放热,放出有毒的腐蚀性烟气 |
| FeCl3 | 306 | 315 | 易溶于水,难溶于苯等有机物 |
| MgCl2 | 714 | 1412 | 易溶于水,难溶于苯等有机物 |
| SiCl4 | -70 | 57.6 | 溶于苯、四氯化碳等非极性溶剂,遇水剧烈反应 |
(1)煅烧过程中主要反应的化学方程式为
(2)“水解”发生的化学方程式为
(3)在上述工艺流程中可以循环使用的物质是
(4)测定产物
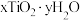 组成的方法如下:
组成的方法如下:步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将
 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用
 的NH4Fe(SO4)2标准溶液滴定,将
的NH4Fe(SO4)2标准溶液滴定,将 氧化为
氧化为 。重复滴定2次。滴定所得相关数据如下表:
。重复滴定2次。滴定所得相关数据如下表:| 滴定序号 | 待测液体积/mL | 滴定起点读数/mL | 滴定终点读数/mL |
| 1 | 25.00 | 0.02 | 24.02 |
| 2 | 25.00 | 0.08 | 24.06 |
| 3 | 25.00 | 0.12 | 24.14 |
②通过计算确定该样品的组成为
(5)从TiO2获得单质钛可以采用FFC-熔盐电脱氧法,具体流程为:将二氧化钛压制成型,经过预烧结,制备成电解体系的阴极,石墨作惰性阳极,以氯化钠、氯化钙为混合熔盐,在低于一定电压条件下电解,阴极生成金属钛。写出阴极的电极反应式
您最近一年使用:0次
名校
2 . 硼及其化合物在生产中有广泛用途,硼和铝位于同主族,具有相似的化学性质。
(1)硼和氯气反应生成BCl3,在该分子中,硼原子最外层有___________ 个电子。
(2)NaBH4是有机合成中重要的还原剂。工业上合成方法之一是: ,在该反应中,氧化剂是
,在该反应中,氧化剂是___________ ,制备 时转移
时转移___________ mol电子。
(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离: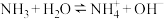 ,硼酸在水中电离的方程式为
,硼酸在水中电离的方程式为___________ 。
(4)过硼酸钠(NaBO3)是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学方程式___________ 。
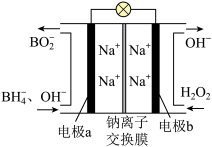
(5)以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是___________。
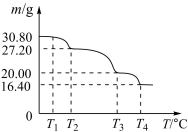
(6)过硼酸钠晶体( )可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为___________ 。
(1)硼和氯气反应生成BCl3,在该分子中,硼原子最外层有
(2)NaBH4是有机合成中重要的还原剂。工业上合成方法之一是:
 ,在该反应中,氧化剂是
,在该反应中,氧化剂是 时转移
时转移(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离:
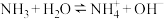 ,硼酸在水中电离的方程式为
,硼酸在水中电离的方程式为(4)过硼酸钠(NaBO3)是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学方程式
(5)以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是___________。

A.电池放电时 从a极区移向b极区 从a极区移向b极区 |
B.该电池a极的反应为 |
| C.电极b采用Pt/C,该极溶液的pH增大 |
D.电池总反应: |
(6)过硼酸钠晶体(
 )可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
您最近一年使用:0次
3 . 党的二十大报告强调科技创新是提高社会生产力和综合国力的战略支撑,化学科学与社会、生活息息相关。下列说法正确的是
| A.SiO2具有导电性,可用于制作光导纤维和光电池 |
| B.国产大飞机一C919使用的碳纤维是一种有机高分子材料 |
| C.海水提溴、煤的液化都涉及化学变化 |
| D.汉朝淮南王刘安发明的“石膏点豆腐”,说明硫酸钙能使蛋白质变性 |
您最近一年使用:0次
名校
4 . 载人航天器是航天员赖以生存的空间,必须给航天员提供基本的生存条件,涉及氧气再生,二氧化碳清除,水处理等。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,发生萨巴蒂尔反应,方程式:CO2(g)+4H2(g) 2H2O(g)+CH4(g),萨巴蒂尔反应生成的水可电解产生氧气,实现氧再生。
2H2O(g)+CH4(g),萨巴蒂尔反应生成的水可电解产生氧气,实现氧再生。
①已知H2O(g)=H2O(l) ΔH= - 44kJ/mol,H2的燃烧热ΔH为286 kJ/mol ,CH4的燃烧热ΔH为- 890.6 kJ/mol,则萨巴蒂尔反应的ΔH___________ 。有利于萨巴蒂尔反应的条件是___________ 。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②在恒容密闭容器中加入CO2和H2,其分压分别20kPa和40kPa,一定条件下发生萨巴蒂尔反应。某时刻测得H2O(g)的分压15kPa,CH4的反应速率v(CH4)=1.2×10-6p(CO2)p4(H2)(kPa·s-1),则该时刻v(H2)=___________ 。
(2)已知萨巴蒂尔反应Ⅰ发生的同时也会发生副反应Ⅱ:
反应Ⅰ:CO2(g)+4H2(g) 2H2O(g)+CH4(g) ΔH1
2H2O(g)+CH4(g) ΔH1
反应Ⅱ:CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2=+41.2kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2kJ/mol
将CO2和H2按体积比1:4混合(n总=5 mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应Ⅰ和反应Ⅱ反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)___________ v逆(a)(填“>”“=”或“<”)。
②Ru/TiO2催化剂在较低温度主要选择___________ (填“反应Ⅰ”或“反应Ⅱ”),试从反应动力学角度分析其原因___________ 。
③350℃~ 400℃温度区间,CO2转化率呈现减小的变化趋势,其可能原因是___________ 。
A.催化剂活性降低 B.平衡常数变小 C.副反应增多 D.反应活化能增大
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=___________ 。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,发生萨巴蒂尔反应,方程式:CO2(g)+4H2(g)
 2H2O(g)+CH4(g),萨巴蒂尔反应生成的水可电解产生氧气,实现氧再生。
2H2O(g)+CH4(g),萨巴蒂尔反应生成的水可电解产生氧气,实现氧再生。①已知H2O(g)=H2O(l) ΔH= - 44kJ/mol,H2的燃烧热ΔH为286 kJ/mol ,CH4的燃烧热ΔH为- 890.6 kJ/mol,则萨巴蒂尔反应的ΔH
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②在恒容密闭容器中加入CO2和H2,其分压分别20kPa和40kPa,一定条件下发生萨巴蒂尔反应。某时刻测得H2O(g)的分压15kPa,CH4的反应速率v(CH4)=1.2×10-6p(CO2)p4(H2)(kPa·s-1),则该时刻v(H2)=
(2)已知萨巴蒂尔反应Ⅰ发生的同时也会发生副反应Ⅱ:
反应Ⅰ:CO2(g)+4H2(g)
 2H2O(g)+CH4(g) ΔH1
2H2O(g)+CH4(g) ΔH1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+ H2O(g) ΔH2=+41.2kJ/mol
CO(g)+ H2O(g) ΔH2=+41.2kJ/mol将CO2和H2按体积比1:4混合(n总=5 mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应Ⅰ和反应Ⅱ反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)
②Ru/TiO2催化剂在较低温度主要选择
③350℃~ 400℃温度区间,CO2转化率呈现减小的变化趋势,其可能原因是
A.催化剂活性降低 B.平衡常数变小 C.副反应增多 D.反应活化能增大
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=
您最近一年使用:0次
名校
解题方法
5 . 下列说法正确的是
| A.第四周期的金属元素从左到右,元素的金属性依次减弱 |
| B.硫难溶于水,微溶解于酒精,易溶于CS2,说明分子极性:水>酒精>CS2 |
| C.可燃冰是天然气与水在低温高压条件下以氢键形成的类冰状结晶物质 |
| D.臭氧是弱极性分子,它在水中的溶解度高于在四氯化碳中的溶解度 |
您最近一年使用:0次
6 . 冷敷袋俗称冰袋,在生活中有降温的功能,下列不可以用于冷敷袋盛装物质的是
| A.十水合碳酸钠(Na2CO3·10H2O)与硝酸铵混合 | B.过氧化钠与水混合 |
| C.硝酸铵与水混合 | D.冰 |
您最近一年使用:0次
名校
解题方法
7 . 赤铁矿的主要成分为Fe2O3,为测定赤铁矿矿样中铁的百分含量,有如下两种预处理方法:
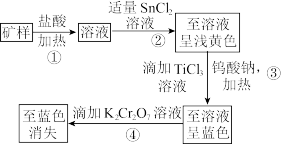
已知:①Sn、Hg、Ti在溶液中存在的形式有Sn2+、Sn4+、Hg2+、H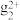 、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
②钨酸钠(Na2WO4)可作指示剂,若W(Ⅵ)还原为W(Ⅴ),溶液将呈现蓝色。氧化性:Fe3+>W 。
。
(1)矿样与盐酸反应的主要化学方程式为___________ 。
(2)过程①发生反应的离子方程式为___________ ,过程②产生的沉淀是___________ (填化学式)。
(3)Na2WO4中W的化合价为___________ ,加入指示剂钨酸钠(Na2WO4)的作用是___________ 。
(4)现称取0.2 g矿样进行上述预处理后,加入H2SO4-H3PO4混酸溶液,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,消耗0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL。
①配平滴定时发生反应的离子方程式: Fe2++
Fe2++ Cr2
Cr2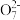 +
+ H+=
H+= Fe3++
Fe3++ Cr3++
Cr3++ H2O
H2O___________ 。
②原矿样中铁的百分含量为___________ ,若矿样预处理后溶液放置过久,对测定结果的影响是___________ (填“偏高”、“偏低”或“无影响”)。

已知:①Sn、Hg、Ti在溶液中存在的形式有Sn2+、Sn4+、Hg2+、H
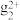 、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。
、Ti3+、TiO2+,且Sn2+能与K2Cr2O7反应,而Hg2+不能;氯化汞溶于水,氯化亚汞不溶于水(白色沉淀)。②钨酸钠(Na2WO4)可作指示剂,若W(Ⅵ)还原为W(Ⅴ),溶液将呈现蓝色。氧化性:Fe3+>W
 。
。(1)矿样与盐酸反应的主要化学方程式为
(2)过程①发生反应的离子方程式为
(3)Na2WO4中W的化合价为
(4)现称取0.2 g矿样进行上述预处理后,加入H2SO4-H3PO4混酸溶液,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,消耗0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL。
①配平滴定时发生反应的离子方程式:
 Fe2++
Fe2++ Cr2
Cr2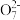 +
+ H+=
H+= Fe3++
Fe3++ Cr3++
Cr3++ H2O
H2O②原矿样中铁的百分含量为
您最近一年使用:0次
名校
解题方法
8 . 许多无机颜料在多彩的世界中扮演了重要角色。如历史悠久的铅白[2PbCO3·Pb(OH)2]、安全环保的钛白(TiO2)、鲜艳的朱砂(HgS)、稳定的金粉(Au)等。上述颜料未涉及的物质类别是
| A.氧化物 | B.单质 | C.碱 | D.盐 |
您最近一年使用:0次
名校
解题方法
9 . 含氮物质的过量排放会污染大气,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)O3氧化性强于 O2,工业烟气中的 NO 经 O3处理后再用碱液吸收而实现脱除。
① 已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284.2 kJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=___________ kJ·mol-1。
② 保持烟气气流速率一定、其他条件相同,NO 脱除率随反应温度变化如图所示。温度超过 150 ℃时,温度升高,NO 脱除率下降,可能的原因是___________ 。

(2)铁元素与EDTA的配合物中,只有亚铁配合物[Fe(Ⅱ)EDTA]能吸附氮氧化物, Fe(Ⅱ)EDTA吸附NO生成Fe(Ⅱ)EDTA•NO,连二亚硫酸钠(Na2S2O4)与吸附后的溶液反应可以实现吸附剂再生,同时生成(NH4)2SO3。
① EDTA的化学名为乙二胺四乙酸,结构简式如下图所示。在Fe(Ⅱ)EDTA中,乙二胺四乙酸根和 Fe2+形成六配位离子。其中配位键的形成方式是___________ 。

② 写出吸附剂再生反应的离子方程式:___________ 。
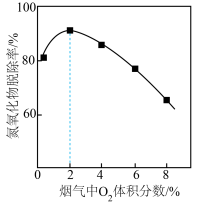
③ Fe(Ⅱ)EDTA吸收烟气中氮氧化物,其他条件相同时,烟气中O2含量对氮氧化物去除率的影响如图所示。在O2含量2 %前后,氮氧化物脱除率先升高后降低的原因是___________ 。
(1)O3氧化性强于 O2,工业烟气中的 NO 经 O3处理后再用碱液吸收而实现脱除。
① 已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284.2 kJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=
② 保持烟气气流速率一定、其他条件相同,NO 脱除率随反应温度变化如图所示。温度超过 150 ℃时,温度升高,NO 脱除率下降,可能的原因是

(2)铁元素与EDTA的配合物中,只有亚铁配合物[Fe(Ⅱ)EDTA]能吸附氮氧化物, Fe(Ⅱ)EDTA吸附NO生成Fe(Ⅱ)EDTA•NO,连二亚硫酸钠(Na2S2O4)与吸附后的溶液反应可以实现吸附剂再生,同时生成(NH4)2SO3。
① EDTA的化学名为乙二胺四乙酸,结构简式如下图所示。在Fe(Ⅱ)EDTA中,乙二胺四乙酸根和 Fe2+形成六配位离子。其中配位键的形成方式是

② 写出吸附剂再生反应的离子方程式:
③ Fe(Ⅱ)EDTA吸收烟气中氮氧化物,其他条件相同时,烟气中O2含量对氮氧化物去除率的影响如图所示。在O2含量2 %前后,氮氧化物脱除率先升高后降低的原因是

您最近一年使用:0次
2023-10-05更新
|
77次组卷
|
2卷引用:河北省保定市河北安国中学等4校2022-2023学年高三上学期11月期中化学试题
10 . 联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,回答下列问题:
I、
(1)联氨的结构式为___________ 。
(2)火箭发射时可以用联氨作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
①2O2(g)+N2(g)=2NO2(g) △H1=+66.4kJ/mol
②N2H4(l)+O2(g)=N2(g)+2H2O(l) △H2=-622.0kJ/mol
③H2O(l)=H2O(g) △H3=+44.0kJ/mol
请写出N2H4(l)与NO2(g)反应的热化学方程式___________ 。
II、肼(N2H4)─空气燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,某学习小组利用该电池来探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
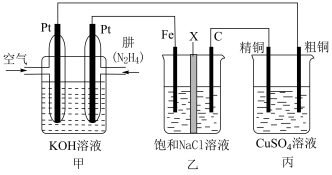
(3)乙装置中石墨电极为___________ 极(填“正”或“负”、“阴”或“阳”),Fe电极反应式为___________ 。
(4)丙装置模拟工业中的粗铜精炼原理,电解后精铜质量增加3.2g,则理论上甲装置中肼消耗质量为___________ g。
(5)如果将丙中的粗铜电极换为Pt电极,该溶液中pH___________ (填“变大”“变小”“不变”),电解一段时间后溶液蓝色变浅,但并未消失,要想把此时的溶液恢复至原状态,需加入适量的___________ (填化学式)。
I、
(1)联氨的结构式为
(2)火箭发射时可以用联氨作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
①2O2(g)+N2(g)=2NO2(g) △H1=+66.4kJ/mol
②N2H4(l)+O2(g)=N2(g)+2H2O(l) △H2=-622.0kJ/mol
③H2O(l)=H2O(g) △H3=+44.0kJ/mol
请写出N2H4(l)与NO2(g)反应的热化学方程式
II、肼(N2H4)─空气燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,某学习小组利用该电池来探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

(3)乙装置中石墨电极为
(4)丙装置模拟工业中的粗铜精炼原理,电解后精铜质量增加3.2g,则理论上甲装置中肼消耗质量为
(5)如果将丙中的粗铜电极换为Pt电极,该溶液中pH
您最近一年使用:0次



