解题方法
1 . 下图是氮的化合物的“价类二维图”。______ ,该物质的电子式_____ 。
(2)写出实验室制取氨气的化学方程式:______ 。
(3)实验室中硝酸通常保存在棕色瓶中,硝酸保存在棕色瓶中的原因:____ (请用方程式解释。)
(4)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。铜与浓硝酸反应的化学方程式为_____ ;以上反应中酸性与氧化性硝酸的物质的量之比_____ 。
(5)工业生产中为了盛装大量浓硝酸,可选择_____ 作为罐体材料。
a.铜 b.铝 c.铂 d.镁
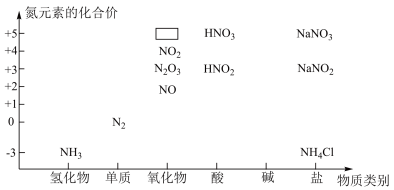
(2)写出实验室制取氨气的化学方程式:
(3)实验室中硝酸通常保存在棕色瓶中,硝酸保存在棕色瓶中的原因:
(4)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。铜与浓硝酸反应的化学方程式为
(5)工业生产中为了盛装大量浓硝酸,可选择
a.铜 b.铝 c.铂 d.镁
您最近一年使用:0次
解题方法
2 . 有氧时在硝化细菌作用下, 可转化为
可转化为 和
和 ,将离子方程式补充完整(需配平,并用单线桥法标出电子的转移方向和数目)
,将离子方程式补充完整(需配平,并用单线桥法标出电子的转移方向和数目)______ 。
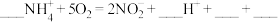 。
。
 可转化为
可转化为 和
和 ,将离子方程式补充完整(需配平,并用单线桥法标出电子的转移方向和数目)
,将离子方程式补充完整(需配平,并用单线桥法标出电子的转移方向和数目)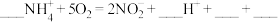 。
。
您最近一年使用:0次
解题方法
3 . Ⅰ.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是___________ 。(写化学式)
(2)步骤②中的离子方程式___________ 。
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:___________ (填“氧化”或“还原”)性;根据上述原理分析,K2FeO4作水处理剂净化水的过程中利用了Fe(OH)3胶体的性质,请写出Fe(OH)3胶体制备的化学方程式:___________ 。
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于___________ (填编号)。
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式___________ 。
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是
(2)步骤②中的离子方程式
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:
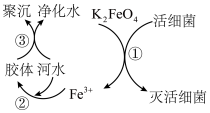
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式
您最近一年使用:0次
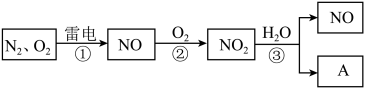
4 . 以下是氮循环的一部分:_____ ;
(2)反应 的化学方程式是
的化学方程式是_____ ;
(3) 易溶于水,并和水发生化学反应。该反应中,氧化剂是
易溶于水,并和水发生化学反应。该反应中,氧化剂是_____ ;
(4)化合物 的化学式是
的化学式是_____ ;
(5)治理汽车尾气的一种方法是用催化剂使 与
与 发生反应:
发生反应: 。当生成
。当生成 时,被还原的
时,被还原的 为
为_____ 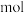 。
。
(2)反应
 的化学方程式是
的化学方程式是(3)
 易溶于水,并和水发生化学反应。该反应中,氧化剂是
易溶于水,并和水发生化学反应。该反应中,氧化剂是(4)化合物
 的化学式是
的化学式是(5)治理汽车尾气的一种方法是用催化剂使
 与
与 发生反应:
发生反应: 。当生成
。当生成 时,被还原的
时,被还原的 为
为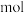 。
。
您最近一年使用:0次
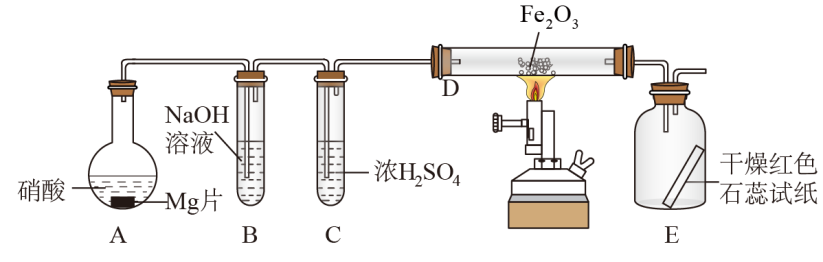
5 . 硝酸与金属反应时,浓度不同生成的还原产物也可能不同,某兴趣小组进行了如下图所示的实验探究,实验现象及相关数据如下:
②从C进入D中的气体有两种,且体积比为1∶1;
③将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)装置中仪器A的名称___________ ;硝酸与Mg片反应生成的气体成分是___________ (用化学式表示)。
(2)硝酸在装置A的反应中所表现的性质有___________ 。
(3)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明B中生成的这种盐在酸性条件下具有氧化性___________ 。
(4)写出D中发生反应的化学方程式___________ 。
(5)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的 (同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式___________ 。
②从C进入D中的气体有两种,且体积比为1∶1;
③将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)装置中仪器A的名称
(2)硝酸在装置A的反应中所表现的性质有
(3)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明B中生成的这种盐在酸性条件下具有氧化性
(4)写出D中发生反应的化学方程式
(5)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的
 (同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
您最近一年使用:0次
6 . 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.11g由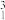 H和 H和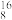 O组成的超重水中,含有的中子数目为5NA O组成的超重水中,含有的中子数目为5NA |
| B.标准状况下,22.4L三氧化硫的分子数约为NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA~0.2NA之间 |
您最近一年使用:0次
21-22高一下·全国·单元测试
解题方法
7 . 烷烃的结构
(1)甲烷的结构
甲烷的空间结构是___________ 结构,___________ 原子位于正四面体的中心,4个___________ 原子位于4个顶点上。分子中的4个C—H的长度和强度___________ ,相互之间的夹角___________ ,为109°28′。
(2)空间示意图是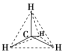 。甲烷的
。甲烷的___________ 模型为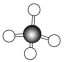 ,空间填充模型为
,空间填充模型为 。
。
(1)甲烷的结构
甲烷的空间结构是
(2)空间示意图是
 。甲烷的
。甲烷的 ,空间填充模型为
,空间填充模型为 。
。
您最近一年使用:0次
8 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
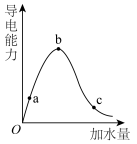
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A.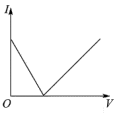 | B.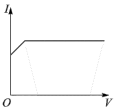 | C.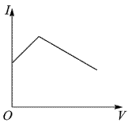 | D.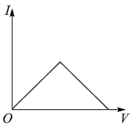 |
您最近一年使用:0次
9 . 钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)常温下,金属钠露置在空气中会发生变化,实验室通常把钠保存在_______ 中。
(2)除去碳酸钠固体中碳酸氢钠的方法是______________ 。
(3)实验室在保存含有Fe2+的溶液时,为了防止Fe2+变质,经常向其中加入_______ (填“铁粉”或“铜粉”)。
(4)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式:_______________ 。
(5)铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物,是因为Al和Al2O3均能与酸、碱反应。则Al2O3属于__________ (填“碱性”或“两性”)氧化物。
(1)常温下,金属钠露置在空气中会发生变化,实验室通常把钠保存在
(2)除去碳酸钠固体中碳酸氢钠的方法是
(3)实验室在保存含有Fe2+的溶液时,为了防止Fe2+变质,经常向其中加入
(4)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式:
(5)铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物,是因为Al和Al2O3均能与酸、碱反应。则Al2O3属于
您最近一年使用:0次
10 . 实验室需要0.1 mol⋅L NaOH溶液450 mL和0.5 mol⋅L
NaOH溶液450 mL和0.5 mol⋅L 硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________ (填字母)。仪器C的名称是___________ ,本实验所需玻璃仪器E的规格和名称是___________ 。___________ (填“大于”“等于”或“小于”,下同)0.1 mol⋅L 。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度
。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度___________ 0.1 mol⋅L 。
。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g⋅cm 的浓硫酸的体积为
的浓硫酸的体积为___________ mL(计算结果保留一位小数)。如果实验室有10 mL、25 mL、50 mL量筒,应选用___________ mL规格的量筒最好。
(4)如果定容时不小心超过刻度线,应如何操作:___________ 。
 NaOH溶液450 mL和0.5 mol⋅L
NaOH溶液450 mL和0.5 mol⋅L 硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是
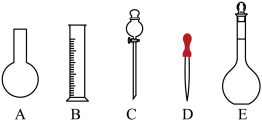
 。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度
。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 。
。(3)根据计算得知,所需质量分数为98%、密度为1.84 g⋅cm
 的浓硫酸的体积为
的浓硫酸的体积为(4)如果定容时不小心超过刻度线,应如何操作:
您最近一年使用:0次



