名校
解题方法
1 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
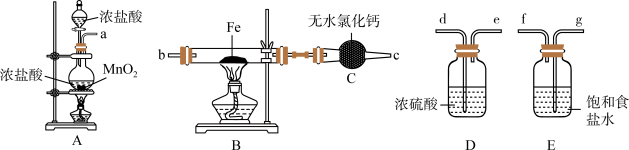
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
80次组卷
|
2卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一上学期期末考试化学试题
解题方法
2 . 在化学活动周中,某校兴趣小组的同学在老师指导下探究铁元素相关物质的性质。回答下列问题:
(1)实验室现有一瓶 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式_______ 。为了证明制得的红褐色液体属于胶体,可以使用的方法是_______ ;乙同学将少量钠单质投入氯化铁溶液中制得铁单质,请评价这一实验方案的可行性_______ (若可行,请写出发生反应的离子方程式,若不可行,请说明理由)。
(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置 是实验室用草酸
是实验室用草酸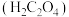 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
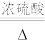
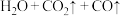 。
。
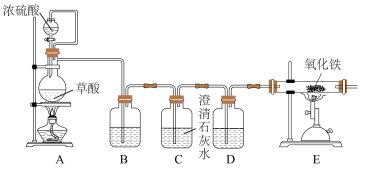
①装置B中盛放的药品为_______ ,装置D的作用为_______ 。
②在实验开始前,应先打开装置_______ (选填“A”或“E”)中的加热装置。写出装置 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移_______ ,其中氧化产物与还原产物的质量比为_______ 。
③该装置的主要缺陷是_______ 。
(1)实验室现有一瓶
 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置
 是实验室用草酸
是实验室用草酸 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
 。
。
①装置B中盛放的药品为
②在实验开始前,应先打开装置
 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移③该装置的主要缺陷是
您最近一年使用:0次
名校
3 . 化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.影响化学平衡的因素
 溶液中存在平衡:
溶液中存在平衡: (蓝色)
(蓝色)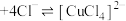 (黄色)
(黄色)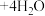
(1)取两支试管,分别加入2 mL 0.5 mol/L 溶液,溶液呈绿色,其原因为
溶液,溶液呈绿色,其原因为____________ 。
(2)将其中一支试管加热,溶液变为黄绿色,则该反应的
______ 0(填“>”或“<”),在另一支试管中加入5滴 溶液,静置,上层清液呈
溶液,静置,上层清液呈______ 色。
Ⅱ.电离平衡常数
(3) 是二元弱酸,其电离平衡常数
是二元弱酸,其电离平衡常数 的表达式为
的表达式为______ 。
(4)向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L 溶液,观察到试管中有气泡产生,由此推断的
溶液,观察到试管中有气泡产生,由此推断的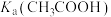
______ 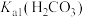 (填“>”或“<”),发生反应的离子方程式为
(填“>”或“<”),发生反应的离子方程式为____________ 。
Ⅲ.盐类水解的应用
(5)向一支试管中加入少量 晶体,然后加入5 mL蒸馏水、振荡,观察到
晶体,然后加入5 mL蒸馏水、振荡,观察到 慢慢溶解,但有少量浑浊,此溶液的pH
慢慢溶解,但有少量浑浊,此溶液的pH______ 7(填“>”“<”或“=”),配制 溶液的正确方法是
溶液的正确方法是____________ 。
(6)向一个烧杯中加入40 mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和 溶液,继续煮沸制得
溶液,继续煮沸制得 胶体。该反应的化学方程式为
胶体。该反应的化学方程式为____________ , 胶体呈
胶体呈______ 色。
Ⅳ.亚铁离子的检验
(7) 与
与______ 色的 溶液反应有特征蓝色沉淀产生,这是检验溶液中
溶液反应有特征蓝色沉淀产生,这是检验溶液中 的常用方法。写出该反应的离子方程式:
的常用方法。写出该反应的离子方程式:____________ 。
Ⅰ.影响化学平衡的因素
 溶液中存在平衡:
溶液中存在平衡: (蓝色)
(蓝色)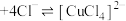 (黄色)
(黄色)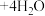
(1)取两支试管,分别加入2 mL 0.5 mol/L
 溶液,溶液呈绿色,其原因为
溶液,溶液呈绿色,其原因为(2)将其中一支试管加热,溶液变为黄绿色,则该反应的

 溶液,静置,上层清液呈
溶液,静置,上层清液呈Ⅱ.电离平衡常数
(3)
 是二元弱酸,其电离平衡常数
是二元弱酸,其电离平衡常数 的表达式为
的表达式为(4)向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L
 溶液,观察到试管中有气泡产生,由此推断的
溶液,观察到试管中有气泡产生,由此推断的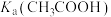
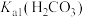 (填“>”或“<”),发生反应的离子方程式为
(填“>”或“<”),发生反应的离子方程式为Ⅲ.盐类水解的应用
(5)向一支试管中加入少量
 晶体,然后加入5 mL蒸馏水、振荡,观察到
晶体,然后加入5 mL蒸馏水、振荡,观察到 慢慢溶解,但有少量浑浊,此溶液的pH
慢慢溶解,但有少量浑浊,此溶液的pH 溶液的正确方法是
溶液的正确方法是(6)向一个烧杯中加入40 mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和
 溶液,继续煮沸制得
溶液,继续煮沸制得 胶体。该反应的化学方程式为
胶体。该反应的化学方程式为 胶体呈
胶体呈Ⅳ.亚铁离子的检验
(7)
 与
与 溶液反应有特征蓝色沉淀产生,这是检验溶液中
溶液反应有特征蓝色沉淀产生,这是检验溶液中 的常用方法。写出该反应的离子方程式:
的常用方法。写出该反应的离子方程式:
您最近一年使用:0次
2024-02-11更新
|
82次组卷
|
2卷引用:天津市南开区2023-2024学年高二上学期期末测试化学试题
4 . 胶体和溶液、浊液都是我们生活中常见的分散系,具有特殊性质,生活中常利用其性质。
(1)新冠病毒可以通过气溶胶传播,气溶胶属于胶体的一种,下列叙述错误的是________。
实验室可制备 胶体供学生探究胶体的性质,具体操作方法为:沸腾的蒸馏水中逐滴加入饱和
胶体供学生探究胶体的性质,具体操作方法为:沸腾的蒸馏水中逐滴加入饱和 溶液,继续煮沸至烧杯内液体呈均匀红褐色后停止加热。
溶液,继续煮沸至烧杯内液体呈均匀红褐色后停止加热。
(2)以上反应的化学方程式为:___________ 。
(3)某同学在制备过程中未使用洁净的烧杯(残留少量 固体),加水煮沸并滴入饱和
固体),加水煮沸并滴入饱和 后,观察到产生红褐色沉淀,因为
后,观察到产生红褐色沉淀,因为___________ 。
在一篇关于“生活中的胶体”文章中,介绍了如何利用牛奶或淀粉等生活中常见物质制备胶体,如将少量淀粉分散在水中可得无色澄清透明的淀粉溶液。某同学对“淀粉溶液”这种说法产生了疑惑,为探究“淀粉溶液”到底是溶液还是胶体,同学取材于生活常见材料设计了如下实验:
甲同学预先将少量碘酒溶于水,配置成碘水,并准备如图搭建实验装置。

(4)实验前,甲同学设计了如下表格以记录现象并分析结论:
(5)实际实验过程中,同学不仅观察到了如编号2所预测的实验现象,还观察到了半透膜内的淀粉溶液变蓝,从分散质粒径角度分析产生这两个现象的原因:___________ 。
(1)新冠病毒可以通过气溶胶传播,气溶胶属于胶体的一种,下列叙述错误的是________。
| A.胶体金抗原检测试纸保质期较长,体现了胶体的稳定性 |
| B.在电压作用下,带电胶体微粒可以发生电泳 |
| C.溶液呈电中性,而胶体带电,不呈电中性 |
| D.雾是气溶胶,在阳光下可以观察到丁达尔现象 |
实验室可制备
 胶体供学生探究胶体的性质,具体操作方法为:沸腾的蒸馏水中逐滴加入饱和
胶体供学生探究胶体的性质,具体操作方法为:沸腾的蒸馏水中逐滴加入饱和 溶液,继续煮沸至烧杯内液体呈均匀红褐色后停止加热。
溶液,继续煮沸至烧杯内液体呈均匀红褐色后停止加热。(2)以上反应的化学方程式为:
(3)某同学在制备过程中未使用洁净的烧杯(残留少量
 固体),加水煮沸并滴入饱和
固体),加水煮沸并滴入饱和 后,观察到产生红褐色沉淀,因为
后,观察到产生红褐色沉淀,因为在一篇关于“生活中的胶体”文章中,介绍了如何利用牛奶或淀粉等生活中常见物质制备胶体,如将少量淀粉分散在水中可得无色澄清透明的淀粉溶液。某同学对“淀粉溶液”这种说法产生了疑惑,为探究“淀粉溶液”到底是溶液还是胶体,同学取材于生活常见材料设计了如下实验:
甲同学预先将少量碘酒溶于水,配置成碘水,并准备如图搭建实验装置。

(4)实验前,甲同学设计了如下表格以记录现象并分析结论:
| 编号 | 实验现象 | 实验结论 |
| 1 | 烧杯中溶液呈 | “淀粉溶液”是溶液 |
| 2 | 烧杯中溶液呈 | “淀粉溶液”是胶体 |
(5)实际实验过程中,同学不仅观察到了如编号2所预测的实验现象,还观察到了半透膜内的淀粉溶液变蓝,从分散质粒径角度分析产生这两个现象的原因:
您最近一年使用:0次
5 . 至今为止,铁是人类冶炼和使用最多的金属。铁及其化合物在生产生活中,乃至国防建设等都发挥着重要作用。某校化学社成员对铁的部分重要化合物进行了系列实验。
Ⅰ.四氧化三铁的光热效应在热量感应、电磁波吸收和纳米材料加热方面具有广泛的应用。例如,在医学领域中,可以利用四氧化三铁的光热效应进行热疗,用于治疗肿瘤等疾病。该校化学社成员利用如图所示装置进行了“铁与水蒸气反应”的实验制备 ,请回答下列问题:
,请回答下列问题:
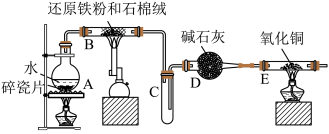
(1)装有碱石灰的仪器D的名称是________ ;装置A的作用是________ 。
(2)装置B中发生反应的化学方程式是________ 。
(3)实验结束后,某成员甲同学认为可以用磁铁吸引产物来确定产物中有未反应的铁粉,有另一成员乙同学认为用此方法判断不妥,你觉得乙同学的依据是________ 。
Ⅱ.氯化铁主要用于金属蚀刻,污水处理。该校化学社成员将Ⅰ中得到的产物溶于稀盐酸中得到溶液a,向溶液a中通入氯气后用此溶液制备 晶体。
晶体。
(4)检验溶液a中是否含 的具体操作及现象为
的具体操作及现象为________ 。
Ⅲ.胶体可以吸附水中悬浮颗粒并沉降而常用来作净水剂。该校化学社成员将得到的 晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
(5)制备方法:在小烧杯中加入50mL蒸馏水,加热至沸腾,向沸水中加入5~6滴饱和 溶液,继续煮沸至液体呈红褐色,停止加热,即可得到
溶液,继续煮沸至液体呈红褐色,停止加热,即可得到 胶体,其反应的化学方程式为
胶体,其反应的化学方程式为________ 。鉴别 胶体和
胶体和 溶液除了观察颜色外,最好的方法是通过
溶液除了观察颜色外,最好的方法是通过________ 判断。
(6)高铁酸钠溶液杀灭病菌后也可以得到氢氧化铁胶体,进而起到净水的作用。其化学反应主要为 (未配平),
(未配平), 的化学式为
的化学式为________ ,请写出配平的化学方程式:________ 。
Ⅰ.四氧化三铁的光热效应在热量感应、电磁波吸收和纳米材料加热方面具有广泛的应用。例如,在医学领域中,可以利用四氧化三铁的光热效应进行热疗,用于治疗肿瘤等疾病。该校化学社成员利用如图所示装置进行了“铁与水蒸气反应”的实验制备
 ,请回答下列问题:
,请回答下列问题:
(1)装有碱石灰的仪器D的名称是
(2)装置B中发生反应的化学方程式是
(3)实验结束后,某成员甲同学认为可以用磁铁吸引产物来确定产物中有未反应的铁粉,有另一成员乙同学认为用此方法判断不妥,你觉得乙同学的依据是
Ⅱ.氯化铁主要用于金属蚀刻,污水处理。该校化学社成员将Ⅰ中得到的产物溶于稀盐酸中得到溶液a,向溶液a中通入氯气后用此溶液制备
 晶体。
晶体。(4)检验溶液a中是否含
 的具体操作及现象为
的具体操作及现象为Ⅲ.胶体可以吸附水中悬浮颗粒并沉降而常用来作净水剂。该校化学社成员将得到的
 晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。
晶体配成饱和溶液,进行实验室制备氢氧化铁胶体实验。(5)制备方法:在小烧杯中加入50mL蒸馏水,加热至沸腾,向沸水中加入5~6滴饱和
 溶液,继续煮沸至液体呈红褐色,停止加热,即可得到
溶液,继续煮沸至液体呈红褐色,停止加热,即可得到 胶体,其反应的化学方程式为
胶体,其反应的化学方程式为 胶体和
胶体和 溶液除了观察颜色外,最好的方法是通过
溶液除了观察颜色外,最好的方法是通过(6)高铁酸钠溶液杀灭病菌后也可以得到氢氧化铁胶体,进而起到净水的作用。其化学反应主要为
 (未配平),
(未配平), 的化学式为
的化学式为
您最近一年使用:0次
名校
解题方法
6 .  元素是自然界中以及生活中常见的元素,请回答下列有关问题。
元素是自然界中以及生活中常见的元素,请回答下列有关问题。
(1)实验室制备氢氧化铁胶体,应向沸水中逐滴加入饱和_________ 溶液(填化学式),至溶液呈透明的_________ 色。
(2)向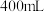 稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的物质的量随铁粉质量的变化如图所示(已知硝酸只被还原为
稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的物质的量随铁粉质量的变化如图所示(已知硝酸只被还原为 气体)。
气体)。

① 段反应的离子方程式为
段反应的离子方程式为__________________ .
②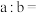
_________ .
③最终溶液中溶质的物质的量浓度约为_________ .
(3)已知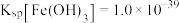 ,若使
,若使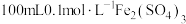 溶液中的
溶液中的 完全沉淀(
完全沉淀( ),应调节
),应调节 最小为
最小为_________ .
(4) 是一种新型高效水处理剂,可用
是一种新型高效水处理剂,可用 和
和 在碱性条件下制备,则该反应的化学方程式为
在碱性条件下制备,则该反应的化学方程式为__________________ .
 元素是自然界中以及生活中常见的元素,请回答下列有关问题。
元素是自然界中以及生活中常见的元素,请回答下列有关问题。(1)实验室制备氢氧化铁胶体,应向沸水中逐滴加入饱和
(2)向
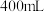 稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的物质的量随铁粉质量的变化如图所示(已知硝酸只被还原为
稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的物质的量随铁粉质量的变化如图所示(已知硝酸只被还原为 气体)。
气体)。
①
 段反应的离子方程式为
段反应的离子方程式为②
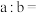
③最终溶液中溶质的物质的量浓度约为
(3)已知
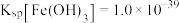 ,若使
,若使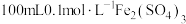 溶液中的
溶液中的 完全沉淀(
完全沉淀( ),应调节
),应调节 最小为
最小为(4)
 是一种新型高效水处理剂,可用
是一种新型高效水处理剂,可用 和
和 在碱性条件下制备,则该反应的化学方程式为
在碱性条件下制备,则该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 制取Fe(OH)3胶体的两个方案如下:

(1)实验1,生成Fe(OH)3胶体的方程式为___________ 。
(2)用最简单的方法判断溶液中是否成功制备胶体,写出相关的操作、现象和结论_________________ ,能产生该现象的原因是胶体粒子对光波的___________ 所致。
(3)实验2与实验1对比,优点是___________ 。
(4)将稀盐酸逐滴加入制得的Fe(OH)3胶体中,实验现象为___________ , 反应方程式为___________ 。
(5)制得的Fe(OH)3胶体中往往混有H+和Cl-,可以利用___________ 的方法来提纯Fe(OH)3胶体。

| 实验 | 实验操作 |
| 1 | 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(质量分数约为30%) |
| 2 | 向40mL蒸馏水中滴入5滴质量分数为10%的FeCl3溶液,然后滴入1滴质量分数为10%的NaOH溶液,边滴边搅拌 |
(1)实验1,生成Fe(OH)3胶体的方程式为
(2)用最简单的方法判断溶液中是否成功制备胶体,写出相关的操作、现象和结论
(3)实验2与实验1对比,优点是
(4)将稀盐酸逐滴加入制得的Fe(OH)3胶体中,实验现象为
(5)制得的Fe(OH)3胶体中往往混有H+和Cl-,可以利用
您最近一年使用:0次
8 . 某兴趣小组以铁丝、氯气、蒸馏水为原料,制备氢氧化铁胶体,并探究胶体的性质。
I.制备氢氧化铁胶体,装置如图1。

(1)请写出①中发生反应的化学方程式并用“单线桥”标出电子转移的方向和数目:___________ 。
(2)③中液体呈红褐色的原因是___________ (填化学方程式)。
Ⅱ.胶体性质的探究。
(3)将②中盛有FeCl3溶液的小烧杯编号甲,将③中盛有红褐色液体的小烧杯编号乙。将甲、乙两只烧杯一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到___________ (填“甲”或“乙”)烧杯的液体中产生了丁达尔效应。
(4)依据图2中的信息,可推出图3中的___________ (填标号)装置可用于提纯氢氧化铁胶体(含FeCl3溶液),选用该装置的理由是___________ 。设计实验证明提纯后的废液中含有CI-,实验操作为___________ ,实验现象为___________ ,该检验过程中发生反应的离子方程式为___________ 。

I.制备氢氧化铁胶体,装置如图1。

(1)请写出①中发生反应的化学方程式并用“单线桥”标出电子转移的方向和数目:
(2)③中液体呈红褐色的原因是
Ⅱ.胶体性质的探究。
(3)将②中盛有FeCl3溶液的小烧杯编号甲,将③中盛有红褐色液体的小烧杯编号乙。将甲、乙两只烧杯一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到
(4)依据图2中的信息,可推出图3中的

您最近一年使用:0次
名校
解题方法
9 . Fe(OH)3胶体具有良好的净水效果,某实验小组尝试制备Fe(OH)3胶体并对其进行性质探究。
(1)制备的实验操作为:将________ 逐滴滴加至_______ 中,待液体呈红褐色后,停止加热;反应方程式为_______ 。
(2)胶体和溶液在外观上并无太大差异,为确认生成的物质是否为胶体,该小组同学采用的操作方法为_______ 。
(3)若向其中逐滴加入稀硫酸至过量,现象是_______ ,解释现象产生的原因为_________ 。
(1)制备的实验操作为:将
(2)胶体和溶液在外观上并无太大差异,为确认生成的物质是否为胶体,该小组同学采用的操作方法为
(3)若向其中逐滴加入稀硫酸至过量,现象是
您最近一年使用:0次
名校
解题方法
10 . 某实验兴趣小组同学用如图所示装置制备氢氧化铁胶体(部分夹持装置已略去)。根据所学知识回答下列问题:
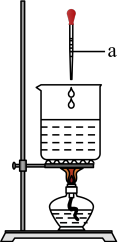
(1)仪器a的名称为_______ 。
(2)氢氧化铁胶体的制备方法:向沸水中逐滴加入5-6滴_______ ,继续煮沸至_______ 。
(3)Fe(OH)3中铁、氢、氧三种元素的质量比是:_______
(4)鉴别Fe(OH)3胶体和FeCl3溶液的具体操作是_______
(5)写出制备胶体的反应方程式:_______ 。

(1)仪器a的名称为
(2)氢氧化铁胶体的制备方法:向沸水中逐滴加入5-6滴
(3)Fe(OH)3中铁、氢、氧三种元素的质量比是:
(4)鉴别Fe(OH)3胶体和FeCl3溶液的具体操作是
(5)写出制备胶体的反应方程式:
您最近一年使用:0次
2023-09-26更新
|
156次组卷
|
3卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期9月月考化学试题



