2024高三·全国·专题练习
解题方法
1 . 氨基钠(NaNH2)是重要的化学试剂,其与氧气反应的方程式为:4NaNH2+3O2=2NaOH+2NaNO2+2NH3。下列说法正确的是
A.NH3的电子式为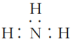 |
| B.n(氧化剂)∶n(还原剂)=3∶2 |
| C.NH3是氧化产物 |
| D.每消耗0.3 mol O2,转移电子数约为2.4×6.02×1023 |
您最近一年使用:0次
解题方法
2 . 丁香酚氧基乙酸不仅有抗病毒、抗菌性能,而且还有抑制脂质增加的功能。纯净的丁香酚氧基乙酸 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将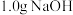 溶于
溶于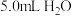 中,添加
中,添加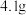 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。
II.将 氯乙酸溶解在
氯乙酸溶解在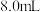 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。
III.将溶液乙缓慢滴加到溶液甲中,在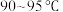 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。
回答下列问题:___________ 。
(2)若步骤I中 加入过量,产生的后果是
加入过量,产生的后果是___________ (用化学方程式表示)。
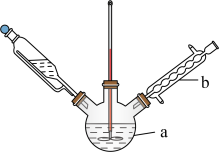
(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器 的名称是
的名称是___________ ;某同学认为不需要仪器 ,他给出的理由是
,他给出的理由是___________ 。
(4)步骤IV中碎冰的作用为___________ 。
(5)步骤V分离提纯方法的名称是___________ 。
(6)本实验的产率为___________ (保留三位有效数字)。
 为白色固体,可用丁香酚(
为白色固体,可用丁香酚( ,沸点:
,沸点: )为主要原料制得,其合成原理如下所示:
)为主要原料制得,其合成原理如下所示:
I.将
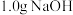 溶于
溶于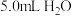 中,添加
中,添加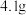 丁香酚,在
丁香酚,在 下搅拌,得到溶液甲。
下搅拌,得到溶液甲。II.将
 氯乙酸溶解在
氯乙酸溶解在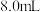 水中,缓慢添加
水中,缓慢添加 溶液使其呈碱性,得到溶液乙。
溶液使其呈碱性,得到溶液乙。III.将溶液乙缓慢滴加到溶液甲中,在
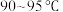 搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。
搅拌混合物1小时,反应完毕后,冷却至室温,加入盐酸至溶液呈酸性,得到溶液丙。IV.向溶液丙中加入碎冰,搅拌至黄色油状物变成淡黄色固体,过滤、洗涤。
V.向固体中加
 ,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到
,加热至沸腾,随后将溶液用冰水冷却。经过滤、洗涤、干燥称量,得到 固体。
固体。回答下列问题:
(2)若步骤I中
 加入过量,产生的后果是
加入过量,产生的后果是(3)某兴趣小组设计的反应装置如图所示(加热装置略去),仪器
 的名称是
的名称是 ,他给出的理由是
,他给出的理由是(4)步骤IV中碎冰的作用为
(5)步骤V分离提纯方法的名称是
(6)本实验的产率为
您最近一年使用:0次
3 . 设NA表示阿伏加德罗常数,下列说法中不正确的是
| A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,如还原产物为NO,则被还原的氮原子数小于NA |
| B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
| C.常温常压下,NA个臭氧分子的体积大于22.4L |
| D.1.8g水中含有的电子总数为NA |
您最近一年使用:0次
名校
4 .  为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是A. 溶液中 溶液中 数目是 数目是 |
B.标准状况下, 与足量 与足量 反应生成 反应生成 分子数为 分子数为 |
C.0.1mol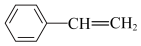 中 中 杂化的碳原子数为 杂化的碳原子数为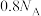 |
D. 分子中含有 分子中含有 键的数目为 键的数目为 |
您最近一年使用:0次
2024-04-22更新
|
1106次组卷
|
6卷引用:题型3 有关NA的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型3 有关NA的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)广西壮族自治区部分学校2023-2024学年高三下学期教学质量监测联考(二模)化学试题江西省部分地区2023-2024学年高三下学期3月月考化学试题甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题河南省九师联盟2023-2024学年高三下学期3月质量检测理科综合化学试题湖北省九师联盟2024届高三下学期3月质量检测(W-G)化学试卷
5 .  代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是
 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是A.标准状况下,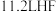 含有的原子数目为 含有的原子数目为 |
B.电解熔融 ,阴极增重 ,阴极增重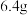 ,外电路中通过电子的数目为 ,外电路中通过电子的数目为 |
C. 和 和 的混合物中含 的混合物中含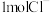 ,则混合物中质子数为 ,则混合物中质子数为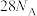 |
D.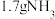 完全溶于 完全溶于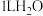 所得的溶液中, 所得的溶液中, 微粒的数目为 微粒的数目为 |
您最近一年使用:0次
名校
解题方法
6 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.46.0gC2H6O完全燃烧,有5NA个C-H断裂 |
| B.25℃时,1LpH=8的CH3COONa溶液中水电离出的OH-数目为10-8NA |
| C.铅酸蓄电池中,当正极理论上增加3.2g时,电路中通过的电子数目为0.1NA |
| D.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数分别为NA、3NA |
您最近一年使用:0次
名校
7 . 锗是一种重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。如图为工业上利用湿法炼锌渣(主要含有 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。
③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
④有机试剂丹宁沉淀金属离子的沉淀率见表。
(1)“浸出”时加热的目的是_______ ,该过程发生的主要反应为_______ ;浸出渣的主要成分是_______ (填化学式)。
(2)浸出后加入 溶液的作用是
溶液的作用是_______ (用离子方程式表示)。滤饼1中主要成分为一种,常温下调节溶液的pH范围为_______ 。如果不加 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成_______ 的不良后果。
(3)“滤液2”中主要含有的金属阳离子是_______ (填离子符号)。
(4) 与纯水反应的化学方程式为
与纯水反应的化学方程式为_______ 。
(5)若含锗3.65%的湿法炼锌渣的质量为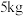 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为_______ 。
 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: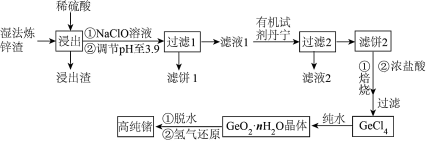
 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
| 离子 |  |  |  |  |
| 开始沉淀pH | 7.5 | 2.2 | 6.2 | 8.2 |
| 完全沉淀pH | 9.0 | 3.2 | 8.2 | 11.2 |
| 离子 |  |  |  |  |
| 沉淀率(%) | 0 | 99 | 0 | 97~98.5 |
(2)浸出后加入
 溶液的作用是
溶液的作用是 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成(3)“滤液2”中主要含有的金属阳离子是
(4)
 与纯水反应的化学方程式为
与纯水反应的化学方程式为(5)若含锗3.65%的湿法炼锌渣的质量为
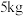 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
您最近一年使用:0次
2024-04-21更新
|
277次组卷
|
3卷引用:T27-工业流程题
8 . 硫代硫酸钠( )在酸性环境中易发生歧化反应:
)在酸性环境中易发生歧化反应: 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 )在酸性环境中易发生歧化反应:
)在酸性环境中易发生歧化反应: 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.18g  中含有质子的数目为 中含有质子的数目为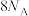 |
B.每生成32g S,转移电子的数目为 |
C.1mol  固体中含有离子的数目为 固体中含有离子的数目为 |
D.常温常压下,22.4L  中含有 中含有 键的数目为 键的数目为 |
您最近一年使用:0次
2024高三下·全国·专题练习
9 . I.“皮鞋很忙的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为_______ g。
(2)配制时,下列操作会导致所配溶液浓度偏高的是_______ 。
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。_______ 、_______ 。(填化学式)
A. 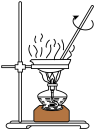 B.
B.  C.
C.
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为
(2)配制时,下列操作会导致所配溶液浓度偏高的是
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。
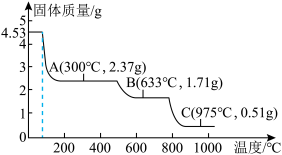
您最近一年使用:0次
10 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.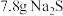 和 和 混合物中含有的离子数为 混合物中含有的离子数为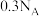 |
B.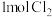 与足量消石灰反应转移的电子数为 与足量消石灰反应转移的电子数为 |
C. 的醋酸溶液中的氢离子数为 的醋酸溶液中的氢离子数为 |
D.标准状况下,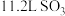 中的氧原子数为 中的氧原子数为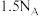 |
您最近一年使用:0次



