名校
1 . (1)已知1.204×1023 个 X 气体分子的质量是 6.4 g,则X 气体的摩尔质量是:_______ ;
(2)同温同压下,同体积的甲烷 CH4气体和CO气体质量之比为_______ ,质子数之比_______ ;
(3)相同质量的 SO2、SO3 的氧原子的个数之比为_______ ;
(4)V L Al2(SO4)3 溶液中含 Al3+ a mol,该 Al2(SO4)3 溶液的物质的量浓度为_____ mol/L,取出 0.5V L 再加入水稀释到4V L,则稀释后的溶液中 SO 的物质的量浓度为
的物质的量浓度为_____ mol/L。
(2)同温同压下,同体积的甲烷 CH4气体和CO气体质量之比为
(3)相同质量的 SO2、SO3 的氧原子的个数之比为
(4)V L Al2(SO4)3 溶液中含 Al3+ a mol,该 Al2(SO4)3 溶液的物质的量浓度为
 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
2 . 能基于物质的量认识物质的组成及其化学变化,是学生必备的学科素养。
(1)已知:①5.6LH2S(标准状况下)②1.204×1023个NH3分子③4.8gCH4④4℃时,5.4mL水,其中含有的氢原子数由大到小的顺序为__ 。
(2)同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO 浓度之比为
浓度之比为__ 。
(3)在标准状况下,将VLHCl溶于0.1L水中,所得溶液的密度为dg·cm-3,则形成溶液的物质的量浓度为__ mol·L-1。
(4)某工厂废液中含有K2Cr2O7,排放废液前要将废液中的Cr2O 还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为
还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为__ mol·L-1。
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。实验室中可用次氯酸钠溶液与氨气反应制备联氨(N2H4),反应的化学方程式为__ 。
(6)用零价铁(Fe)去除水体中的硝酸盐(NO )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。
实验研究表明,将足量铁粉投入 =2.5的水体中,经24小时测得水体中NO
=2.5的水体中,经24小时测得水体中NO 去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH
去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH ,反应0.1molNO
,反应0.1molNO 恰好消耗16.8gFe,则反应的离子方程式为
恰好消耗16.8gFe,则反应的离子方程式为__ 。
(1)已知:①5.6LH2S(标准状况下)②1.204×1023个NH3分子③4.8gCH4④4℃时,5.4mL水,其中含有的氢原子数由大到小的顺序为
(2)同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO
 浓度之比为
浓度之比为(3)在标准状况下,将VLHCl溶于0.1L水中,所得溶液的密度为dg·cm-3,则形成溶液的物质的量浓度为
(4)某工厂废液中含有K2Cr2O7,排放废液前要将废液中的Cr2O
 还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为
还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。实验室中可用次氯酸钠溶液与氨气反应制备联氨(N2H4),反应的化学方程式为
(6)用零价铁(Fe)去除水体中的硝酸盐(NO
 )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。实验研究表明,将足量铁粉投入
 =2.5的水体中,经24小时测得水体中NO
=2.5的水体中,经24小时测得水体中NO 去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH
去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH ,反应0.1molNO
,反应0.1molNO 恰好消耗16.8gFe,则反应的离子方程式为
恰好消耗16.8gFe,则反应的离子方程式为
您最近一年使用:0次
2020-10-24更新
|
225次组卷
|
4卷引用:陕西省渭南市大荔县同州中学2021届高三上学期第一次月考化学试题
陕西省渭南市大荔县同州中学2021届高三上学期第一次月考化学试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练河南省潢川第一中学2023-2024学年高三上学期第一次月考化学试题
名校
3 . I.(1)标准状况下VmLCH4气体所含a个氢原子则NA=_________ 。
(2)相同条件下等质量的CO和CO2气体的体积之比_____ ,密度之比_____ 。
(3)100mL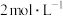 的硫酸铝溶液中c(Al3+)=
的硫酸铝溶液中c(Al3+)=__________ ,5mL该溶液中 的数目
的数目_____ 。(设阿伏加 德罗常数为NA)
II.乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示。利用标签提供的信息,回答下列问题:
(1)乙酸的摩尔质量为__________ 。
(2)若该乙酸溶液的密度为 ,则此乙酸溶液的物质的量浓度表达式为
,则此乙酸溶液的物质的量浓度表达式为_________ 。
(3)某实验中要用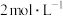 的乙酸溶液200mL,则需用
的乙酸溶液200mL,则需用_______ 量取上述乙酸溶液______ mL进行稀释。
(2)相同条件下等质量的CO和CO2气体的体积之比
(3)100mL
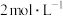 的硫酸铝溶液中c(Al3+)=
的硫酸铝溶液中c(Al3+)= 的数目
的数目II.乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示。利用标签提供的信息,回答下列问题:
| 乙酸 化学式:CH3COOH 分析纯(500mL) 溶质的质量分数:36% |
(2)若该乙酸溶液的密度为
 ,则此乙酸溶液的物质的量浓度表达式为
,则此乙酸溶液的物质的量浓度表达式为(3)某实验中要用
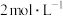 的乙酸溶液200mL,则需用
的乙酸溶液200mL,则需用
您最近一年使用:0次
解题方法
4 . 实验室里常用氯化铵与足量熟石灰混合加热制取氨气:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。 请完成下列各题:
CaCl2+2NH3↑+2H2O。 请完成下列各题:
(1)若需要2240mL(标准状况)氨气,至少需要称取氯化铵的质量是多少_______ (用托盘天平称量)?
(2)若将4480mL氨气(标准状况)溶于水配成100mL溶液,则氨水的物质的量浓度是多少____ (忽略氨水的电离)?
 CaCl2+2NH3↑+2H2O。 请完成下列各题:
CaCl2+2NH3↑+2H2O。 请完成下列各题: (1)若需要2240mL(标准状况)氨气,至少需要称取氯化铵的质量是多少
(2)若将4480mL氨气(标准状况)溶于水配成100mL溶液,则氨水的物质的量浓度是多少
您最近一年使用:0次
2020-10-05更新
|
250次组卷
|
2卷引用:陕西省西安市航空六一八中学2019-2020学年高一上学期期末考试化学试题
解题方法
5 . 请根据物质的量的相关公式,完成下列问题。(注意书写单位)
(1)3.01×1023个NH3分子的物质的量__ 。
(2)0.5molH2SO4含有的氧原子的物质的量__ 。
(3)2.3gNO2的物质的量__ 。
(4)标况下,33.6LN2的物质的量___ 。
(5)0.5mol /LK2SO4溶液中,c(K+)=__ 。
(1)3.01×1023个NH3分子的物质的量
(2)0.5molH2SO4含有的氧原子的物质的量
(3)2.3gNO2的物质的量
(4)标况下,33.6LN2的物质的量
(5)0.5mol /LK2SO4溶液中,c(K+)=
您最近一年使用:0次
2020-10-05更新
|
316次组卷
|
3卷引用:陕西省西安市航空六一八中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
6 . (1)标准状况下,6 g氢气的体积为______ L;标准状况下,体积为11.2 L的CO2的质量为______ g。
(2)标准状况下,某气体的密度为1.25 g∙L-1,则其摩尔质量为______ g∙mol-1。
(3)在标准状况下,体积为8.96 L的CO2气体中共含______ 个原子,质量是______ g。
(4)现有200ml Fe2(SO4)3的溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是______ mol∙L-1,Fe2(SO4)3溶液的物质的量浓度是______ mol∙L-1。
(5)将5mol/L的Mg (NO3)2溶液a mL稀释至b mL,稀释后溶液中NO 的物质的量浓度是
的物质的量浓度是______ mol∙L-1。
(2)标准状况下,某气体的密度为1.25 g∙L-1,则其摩尔质量为
(3)在标准状况下,体积为8.96 L的CO2气体中共含
(4)现有200ml Fe2(SO4)3的溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是
(5)将5mol/L的Mg (NO3)2溶液a mL稀释至b mL,稀释后溶液中NO
 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
名校
7 . 取3.9 g Na2O2溶于水中完全反应后形成250mL溶液,试计算:
(1)反应产生的气体在标准状况下的体积___ ;
(2)所得溶液的物质的量浓度___ 。
(1)反应产生的气体在标准状况下的体积
(2)所得溶液的物质的量浓度
您最近一年使用:0次
2020-09-26更新
|
73次组卷
|
2卷引用:陕西省渭南高级中学2019-2020学年高一上学期第一次月考化学试题
8 . 把400mL0.3mol/L硫酸溶液与400mL0.1mol/LBa(OH)2溶液混合,计算:
(1)能生成硫酸钡___ 克?(保留两位小数)
(2)若反应时忽略体积变化,反应后氢原子的物质的量浓度是___ mol/L?(保留一位小数)
(1)能生成硫酸钡
(2)若反应时忽略体积变化,反应后氢原子的物质的量浓度是
您最近一年使用:0次
9 . 将24.0gNaOH固体溶于水配成100mL溶液,其密度为1.20g﹒mL-1。试计算:.
(1)该溶液中NaOH的物质的量浓度为______ 。
(2)该溶液中NaOH的质量分数为______ 。 。
(3)从该溶液中取出10mL,其中含NaOH的质量为___ 。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______ 。
(1)该溶液中NaOH的物质的量浓度为
(2)该溶液中NaOH的质量分数为
(3)从该溶液中取出10mL,其中含NaOH的质量为
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
您最近一年使用:0次
名校
解题方法
10 . 现有Na2SO4和Na2CO3的混合溶液100mL,加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、烘干,得到白色沉淀14.51g,将沉淀与过量的盐酸反应,得到1120mL(标准状况)CO2气体。请计算原混合液中Na2SO4的物质的量浓度。
您最近一年使用:0次



