2024高三下·全国·专题练习
解题方法
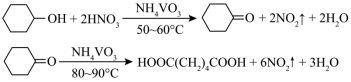
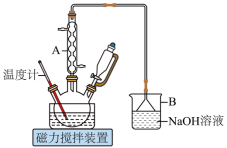
1 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:_______ 。步骤Ⅳ提纯方法的名称为_______ 。如图为1,6己二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为ρg·mL-1;该溶液的物质的量浓度为_______ 。
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:

| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近一年使用:0次
名校
解题方法
2 . 微观探析是认识物质的一种途径。设 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是
 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是A.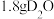 中含有的中子数目为 中含有的中子数目为 |
B.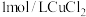 溶液中含有 溶液中含有 的数目小于 的数目小于 |
C.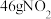 与 与 的混合物中含有的分子数为 的混合物中含有的分子数为 |
D.25℃,101kPa, 与NaOH溶液完全反应,转移电子数目为 与NaOH溶液完全反应,转移电子数目为 |
您最近一年使用:0次
2024-03-06更新
|
880次组卷
|
4卷引用:2024届广东省汕头市高三下学期一模化学试题
名校
3 . 向500 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是

 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
A.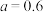 |
B. 时反应为 时反应为 |
C.原溶液中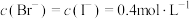 |
D.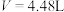 时总反应为 时总反应为 |
您最近一年使用:0次
2024-02-23更新
|
240次组卷
|
2卷引用:湖北省荆州八县市2023-2024学年高一上学期期末联考化学试题
4 . 有一水溶液含有以下离子中的若干种: 、
、 、
、 、
、 、
、 、
、 ,现取两份100 mL的该溶液分别进行如下实验(已知:
,现取两份100 mL的该溶液分别进行如下实验(已知: )
)
(1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体1120mL。
(2)第二份加足量 溶液,得沉淀6.63g,再用足量盐酸洗涤、干燥后得沉淀质量为4.66g。
溶液,得沉淀6.63g,再用足量盐酸洗涤、干燥后得沉淀质量为4.66g。
根据上述实验,下列推测正确的是
 、
、 、
、 、
、 、
、 、
、 ,现取两份100 mL的该溶液分别进行如下实验(已知:
,现取两份100 mL的该溶液分别进行如下实验(已知: )
)(1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体1120mL。
(2)第二份加足量
 溶液,得沉淀6.63g,再用足量盐酸洗涤、干燥后得沉淀质量为4.66g。
溶液,得沉淀6.63g,再用足量盐酸洗涤、干燥后得沉淀质量为4.66g。根据上述实验,下列推测正确的是
A.原溶液中肯定存在的离子为 、 、 、 、 、 、 |
B.原溶液中 的物质的量浓度一定为 的物质的量浓度一定为 |
C.原溶液中一定不存在 |
D.原溶液中 的物质的量浓度为 的物质的量浓度为 |
您最近一年使用:0次
2023-12-21更新
|
527次组卷
|
6卷引用:浙江省丽水发展共同体2023-2024学年高一上学期12月联考化学试题
名校
5 . 将NO2、NO、O2混合气体充满一圆底烧瓶(体积已折算为标况),倒置水中,进行喷泉实验,最后无气体剩余,若所得产物不扩散,则所得溶液的物质的量浓度的数值大小范围为
A.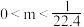 | B.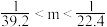 |
C.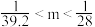 | D.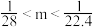 |
您最近一年使用:0次
名校
解题方法
6 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为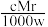 | B.物质的量浓度c可表示为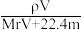 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为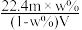 |
您最近一年使用:0次
2023-10-29更新
|
1123次组卷
|
42卷引用:2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷
2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
解题方法
7 . 海带中既含有有机碘化合物又含有碘化钠等无机碘化合物。某课题组探究了海带提碘的优化条件,并用色度计测定了某海带样品中碘的含量。实验步骤:
I.预处理:将干海带刷净,剪成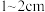 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。
II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到 烧杯中,加入
烧杯中,加入 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。
IV.氧化:向滤液中加入稀 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。
V.萃取:向分液漏斗中加入 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。
VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以 的形式存在。
的形式存在。
回答下列问题:
(1)第II步中的仪器A是___________ 。
(2)证明第III步滤液中存在 的实验方法是
的实验方法是___________ ,实验现象是___________ 。
(3)第IV步氧化过程中发生反应的离子方程式为___________ 。
(4)第V步可得到 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
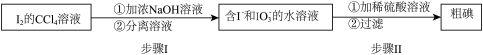
请写出步骤II的离子方程式:___________ 。
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(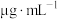 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ 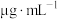 。
。
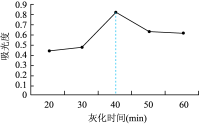
(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。
I.预处理:将干海带刷净,剪成
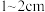 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到
 烧杯中,加入
烧杯中,加入 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。IV.氧化:向滤液中加入稀
 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。V.萃取:向分液漏斗中加入
 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的
 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以
 的形式存在。
的形式存在。回答下列问题:
(1)第II步中的仪器A是
(2)证明第III步滤液中存在
 的实验方法是
的实验方法是(3)第IV步氧化过程中发生反应的离子方程式为
(4)第V步可得到
 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
请写出步骤II的离子方程式:
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(
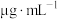 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是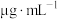 。
。(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是

您最近一年使用:0次
2023-07-03更新
|
149次组卷
|
2卷引用:山西省运城市2022-2023学年高一下学期期末考试化学试题
8 . 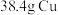 与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在
与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在 溶液中得到
溶液中得到 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示
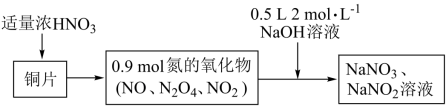
下列有关判断不正确的是
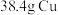 与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在
与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在 溶液中得到
溶液中得到 和
和 的混合溶液,反应过程及有关数据如图所示
的混合溶液,反应过程及有关数据如图所示
下列有关判断不正确的是
| A.硝酸在反应中仅体现氧化性 |
B. 和 和 溶液反应时, 溶液反应时, 作还原剂 作还原剂 |
C.混合气体中 的物质的量是 的物质的量是 |
D.若浓硝酸体积为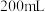 ,则其物质的量浓度为 ,则其物质的量浓度为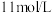 |
您最近一年使用:0次
名校
9 . 同温同压下,向体积均为 的两支量筒中分别充满①②(①HCl和
的两支量筒中分别充满①②(①HCl和 ,②
,② 和
和 )两种混合气体并倒置在盛满水的水槽里,一段时间后,量筒中剩余气体的体积均为
)两种混合气体并倒置在盛满水的水槽里,一段时间后,量筒中剩余气体的体积均为 。假设量筒中溶液的溶质不向水槽中扩散,则两个量筒中溶液的溶质的物质的量浓度之比
。假设量筒中溶液的溶质不向水槽中扩散,则两个量筒中溶液的溶质的物质的量浓度之比 为
为
 的两支量筒中分别充满①②(①HCl和
的两支量筒中分别充满①②(①HCl和 ,②
,② 和
和 )两种混合气体并倒置在盛满水的水槽里,一段时间后,量筒中剩余气体的体积均为
)两种混合气体并倒置在盛满水的水槽里,一段时间后,量筒中剩余气体的体积均为 。假设量筒中溶液的溶质不向水槽中扩散,则两个量筒中溶液的溶质的物质的量浓度之比
。假设量筒中溶液的溶质不向水槽中扩散,则两个量筒中溶液的溶质的物质的量浓度之比 为
为| A.1∶4 | B.5∶4 | C.4∶1 | D.4∶5 |
您最近一年使用:0次
名校
解题方法
10 . 将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。下列有关说法正确的是
| A.11.2 L标准状况下混合气体中NO的体积为5.376 L,NO2的体积为5.824L |
| B.产生的标准状况下11.2 LNO和NO2混合气体通入5.6LO2刚好能溶解到水中 |
| C.反应中参加反应的HNO3的物质的量为0.5mol |
D.待产生的气体全部逸出后,向溶液中加入V mL a mol·L−1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原HNO3溶液的浓度为 mol·L−1 mol·L−1 |
您最近一年使用:0次
2023-03-16更新
|
605次组卷
|
3卷引用:江苏省海安市实验中学2022-2023学年高一第一次月考化学试题



