名校
解题方法
1 . 某工业废水仅含下表中的某些离子(不考虑水电离产生的 和
和 )。
)。
甲同学欲探究废水的组成,进行如下实验:
Ⅰ.取 溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
Ⅱ.取 溶液加入过量盐酸,无气体和沉淀生成。
溶液加入过量盐酸,无气体和沉淀生成。
Ⅲ.取 溶液,滴加过量
溶液,滴加过量 后,过滤、洗涤、干燥得到
后,过滤、洗涤、干燥得到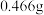 沉淀,滴加足量
沉淀,滴加足量 ,得
,得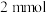 沉淀。
沉淀。
Ⅳ.取 溶液,加入过量
溶液,加入过量 溶液并加热,得到标准状况下
溶液并加热,得到标准状况下 气体。
气体。
请回答下列问题:
(1)以下物质属于电解质的是___________(填字母)。
(2)根据上述信息推断一定存在的阳离子有___________ ,阴离子有___________ 。
(3)实验Ⅰ的现象为___________ 。
(4)实验Ⅲ中发生反应的离子方程式有___________ 、___________ 。
(5)原溶液中浓度最大和最小的离子的物质的量浓度是_______  ,
,_________  。
。
(6)取 溶液,通入
溶液,通入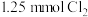 ,对应离子方程式为
,对应离子方程式为___________ 。
 和
和 )。
)。| 阳离子 |  |  |  |  |
| 阴离子 |  |  |  |  |
Ⅰ.取
 溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
溶液,滴加一滴氨水有沉淀生成,且离子种类不变。Ⅱ.取
 溶液加入过量盐酸,无气体和沉淀生成。
溶液加入过量盐酸,无气体和沉淀生成。Ⅲ.取
 溶液,滴加过量
溶液,滴加过量 后,过滤、洗涤、干燥得到
后,过滤、洗涤、干燥得到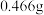 沉淀,滴加足量
沉淀,滴加足量 ,得
,得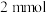 沉淀。
沉淀。Ⅳ.取
 溶液,加入过量
溶液,加入过量 溶液并加热,得到标准状况下
溶液并加热,得到标准状况下 气体。
气体。请回答下列问题:
(1)以下物质属于电解质的是___________(填字母)。
| A.氨气 | B.氨水 | C.液氨 | D.一水合氨 |
(3)实验Ⅰ的现象为
(4)实验Ⅲ中发生反应的离子方程式有
(5)原溶液中浓度最大和最小的离子的物质的量浓度是
 ,
, 。
。(6)取
 溶液,通入
溶液,通入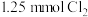 ,对应离子方程式为
,对应离子方程式为
您最近半年使用:0次
名校
2 . 向两份20 ml 0.1 mol/LBa(OH)2溶液中各加入定量的KAl(SO4)2和Al2(SO4)3溶液的导电性随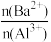 (混合前)的变化关系如图所示,下列分析不正确的是
(混合前)的变化关系如图所示,下列分析不正确的是
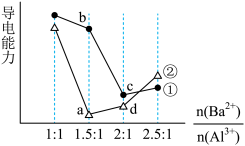
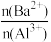 (混合前)的变化关系如图所示,下列分析不正确的是
(混合前)的变化关系如图所示,下列分析不正确的是
| A.a点溶液的pH值约为7 | B.b点溶液中大量存在的阳离子有Al3+和Ba2+ |
| C.c、d两点溶液中OH-均已完全反应 | D.②代表加入Al2(SO4)3的变化曲线 |
您最近半年使用:0次
2023-01-05更新
|
941次组卷
|
3卷引用:安徽省皖南八校2022-2023学年高三上学期第一次大联考化学试题
3 . 下图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色。
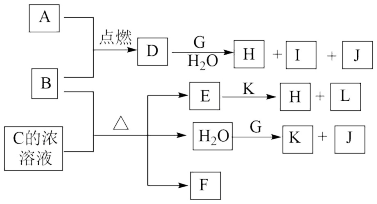
请回答下列问题:
(1)框图中所列物质中属于非电解质的物质是_____________ ;
(2)将D的水溶液蒸干并灼烧得到的固体物质的化学式为___________ ;
(3)在一定物质的量浓度的硝酸铵溶液中滴加适量的K溶液,使溶液的pH=7,则溶液中c(Na+)_______ c( )(选填“>”“=”或“<”)。
)(选填“>”“=”或“<”)。
(4)①4 g J在纯氧中完全燃烧生成液态化合物,放出热量为QkJ,写出表示J燃烧热的热化学方程式_____ 。
②A是重要的化工原料,工业上制取A的反应的化学方程式为___________ 。
(5)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4∶3,已知1 mol A单质与含1 mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则A单质与含M的溶液反应的离子方程式为:_________ 。
(6)25℃时,若Ksp(H)=2.2×10-20,向0.022mol/L的E溶液中逐滴滴入溶液K,当开始出现沉淀时,溶液中的c(OH-)=_________ 。

请回答下列问题:
(1)框图中所列物质中属于非电解质的物质是
(2)将D的水溶液蒸干并灼烧得到的固体物质的化学式为
(3)在一定物质的量浓度的硝酸铵溶液中滴加适量的K溶液,使溶液的pH=7,则溶液中c(Na+)
 )(选填“>”“=”或“<”)。
)(选填“>”“=”或“<”)。(4)①4 g J在纯氧中完全燃烧生成液态化合物,放出热量为QkJ,写出表示J燃烧热的热化学方程式
②A是重要的化工原料,工业上制取A的反应的化学方程式为
(5)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4∶3,已知1 mol A单质与含1 mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则A单质与含M的溶液反应的离子方程式为:
(6)25℃时,若Ksp(H)=2.2×10-20,向0.022mol/L的E溶液中逐滴滴入溶液K,当开始出现沉淀时,溶液中的c(OH-)=
您最近半年使用:0次
名校
4 . 下列叙述正确的是
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对
②C60晶体的晶胞是面心立方结构
③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素
④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子
⑤冰中存在极性共价键和氢键两种化学键的作用
⑥Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中
⑦熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体
⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为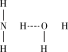
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对
②C60晶体的晶胞是面心立方结构
③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素
④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子
⑤冰中存在极性共价键和氢键两种化学键的作用
⑥Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中
⑦熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体
⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为
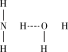
| A.②⑥ | B.②③ | C.⑤⑥ | D.③⑥ |
您最近半年使用:0次
2016-12-09更新
|
1002次组卷
|
2卷引用:2014—2015学年湖北省华中师大一附中高一下期末检测化学试卷
解题方法
5 . (1)某温度下,纯水中的c(H+)=3×10-7 mol/L,滴入稀H2SO4使c(H+)=5×10-6 mol/L,则c(OH-)=______ ,由水电离出的c(H+)为__________ 。
(2)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液;
②0.01 mol·L-1 HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(a)其中水的电离程度相同的是______________ ;(填序号)
(b)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②____ ③(填“>”、“<”或“=”);
(c)将前四份溶液同等稀释10倍后,溶液的pH: ③________ ④ (填“>”、“<”或“=”);
(3)现有十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体
⑥液氯 ⑦CuSO4固体 ⑧酒精 ⑨氯水 ⑩H2SO4
a.上述物质中可导电的是________________ (填序号,以下同);
b.上述物质中属于非电解质的是__________________ 。
(2)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液;
②0.01 mol·L-1 HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(a)其中水的电离程度相同的是
(b)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②
(c)将前四份溶液同等稀释10倍后,溶液的pH: ③
(3)现有十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体
⑥液氯 ⑦CuSO4固体 ⑧酒精 ⑨氯水 ⑩H2SO4
a.上述物质中可导电的是
b.上述物质中属于非电解质的是
您最近半年使用:0次
6 . (1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2: ;
②NaHSO4: ;
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________________
(2)砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O,①反应中还原剂是 ,被还原的元素是 ,(用化学式回答)若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为_________L,
②用双线桥法标出上述反应中电子转移的方向和数目。
(3)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl.某学生设计了如图所示方案提取纯净的NaCl溶液.(已知:NH4HCO3 NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
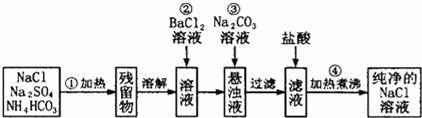
①150℃时,一定量的NH4HCO3完全分解后所得气体的平均相对分子质量为 (保留至小数点后一位).
②操作③所得到的悬浊液与胶体的本质区别是 .
③进行操作②后,判断SO42﹣是否已除尽方法是 .
④操作②加BaCl2溶液后生成沉淀,不必进行过滤就可进行操作③加碳酸钠溶液,其理由是 .
①Ba(OH)2: ;
②NaHSO4: ;
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________________
(2)砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O,①反应中还原剂是 ,被还原的元素是 ,(用化学式回答)若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为_________L,
②用双线桥法标出上述反应中电子转移的方向和数目。
(3)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl.某学生设计了如图所示方案提取纯净的NaCl溶液.(已知:NH4HCO3
 NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
①150℃时,一定量的NH4HCO3完全分解后所得气体的平均相对分子质量为 (保留至小数点后一位).
②操作③所得到的悬浊液与胶体的本质区别是 .
③进行操作②后,判断SO42﹣是否已除尽方法是 .
④操作②加BaCl2溶液后生成沉淀,不必进行过滤就可进行操作③加碳酸钠溶液,其理由是 .
您最近半年使用:0次



