解题方法
1 . Ⅰ以下是实验室及生活中常见的一些物质:①液氯、②稀H2SO4、③CO2、④石灰水、⑤氯水、⑥氢氧化钠溶液、⑦CaO、⑧酒精、⑨Cu,请根据要求填空:
(1)属于酸性氧化物的是______ ;属于电解质的是________ 。(填序号)
(2)②在水中的电离方程式为_________ 。
(3)写出①与⑥溶液反应的离子方程式:______ 。
Ⅱ、过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验,请回答以下问题:
(4)纯净的Na2O2是________ 色固体,其中氧元素的化合价为_________ 价。
该实验小组为了粗略测定过氧化钠的质量分数,称取了20.0 g样品,并设计用如图装置通过排水法测定E中收集到的O2的体积,来测定过氧化钠的质量分数。
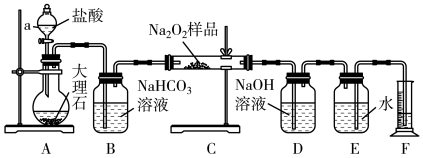
(5)将仪器连接好以后、加药品之前必须进行的一步操作_____ ,A中主要反应的离子方程式:_____ ;
(6)装置B的作用是除去二氧化碳气体中的______ 气体,写出相应的化学方程式_____ 。读出量筒内水的体积后,将其折算成标准状况下氧气的体积为2.24L,则样品中过氧化钠的质量分数为_____ 。
(1)属于酸性氧化物的是
(2)②在水中的电离方程式为
(3)写出①与⑥溶液反应的离子方程式:
Ⅱ、过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验,请回答以下问题:
(4)纯净的Na2O2是
该实验小组为了粗略测定过氧化钠的质量分数,称取了20.0 g样品,并设计用如图装置通过排水法测定E中收集到的O2的体积,来测定过氧化钠的质量分数。

(5)将仪器连接好以后、加药品之前必须进行的一步操作
(6)装置B的作用是除去二氧化碳气体中的
您最近一年使用:0次
名校
2 . 化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾 。具体制备流程如下:
。具体制备流程如下:

回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为: (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_____ ,氧化产物是_____ (填化学式)。
(2)所得气体产物 属于
属于_____ (填“电解质”或“非电解质”)。技术员用氨水对“气体产物”进行吸收后再处理,可以回收 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式_____ 。所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_____ 。
(3)加入足量X时发生反应的离子方程式为:_____ 。
(4)叙述检验绿矾中硫酸根离子的操作:_____ 。
(5)绿矾保存不当,容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中,加水溶解,向溶液中加入_____ 溶液,发现_____ (填现象),则绿矾已经变质。
(6)充分灼烧15.0g绿矾产品,可得到4.0g某种红棕色固体。则该红棕色固体是_____ (填化学式),该绿矾产品的纯度为_____ (结果保留一位小数)。
 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾 。具体制备流程如下:
。具体制备流程如下:
回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为:
 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(2)所得气体产物
 属于
属于 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为(3)加入足量X时发生反应的离子方程式为:
(4)叙述检验绿矾中硫酸根离子的操作:
(5)绿矾保存不当,容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中,加水溶解,向溶液中加入
(6)充分灼烧15.0g绿矾产品,可得到4.0g某种红棕色固体。则该红棕色固体是
您最近一年使用:0次
名校
解题方法
3 . 化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为Fe2O3及少量FeS、SiO2等)来制取绿矾FeSO4•7H2O。具体制备流程如下:

回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为: (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ ,氧化产物是_______ (填化学式)。
(2)所得气体产物 属于
属于_______ (填“电解质”或“非电解质”)。技术员用氨水对“气体产物”进行吸收后再处理,可以回收 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式_______ 。所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
(3)加入足量X时发生反应的离子方程式为:_______ 。
(4)系列操作包括:_______ 、_______ 、过滤、洗涤、干燥。
(5)绿矾保存不当,容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中,加水溶解,向溶液中加入_______ 溶液,发现_______ (填现象),则绿矾已经变质。

回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为:
 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(2)所得气体产物
 属于
属于 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为(3)加入足量X时发生反应的离子方程式为:
(4)系列操作包括:
(5)绿矾保存不当,容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中,加水溶解,向溶液中加入
您最近一年使用:0次
名校
解题方法
4 . 按照要求回答下列问题。
(1)已知下列七种物质:①NaCl②Cu③SO2④氯化铁溶液⑤稀硫酸⑥硫酸钡⑦熔融KNO3,其中属于电解质的是____ 。
(2)工业中常将钠块加入正己烷中,除去微量的水,反应的化学方程式为____ ;若将23g钠与一定量的水发生上述反应,最终形成1L的溶液,其溶液的物质的量浓度为____ ,同时生成的气体在标准状况下的体积为____ 。
(3)利用焰色试验的原理既可制作五彩缤纷的节日烟花,也可定性鉴别某些金属盐,立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。灼烧立德粉样品时,钡的焰色为____ 。
(4)工业废水中含有的重铬酸根离子(Cr2O )有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O
)有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。
+14H+=6Fe3++2Cr3++7H2O。
①在该反应中还原产物是____ (填离子符号);
②用单线桥标出该反应电子转移的方向和数目____ 。
(1)已知下列七种物质:①NaCl②Cu③SO2④氯化铁溶液⑤稀硫酸⑥硫酸钡⑦熔融KNO3,其中属于电解质的是
(2)工业中常将钠块加入正己烷中,除去微量的水,反应的化学方程式为
(3)利用焰色试验的原理既可制作五彩缤纷的节日烟花,也可定性鉴别某些金属盐,立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。灼烧立德粉样品时,钡的焰色为
| A.黄色 | B.砖红色 | C.紫色 | D.黄绿色 |
(4)工业废水中含有的重铬酸根离子(Cr2O
 )有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O
)有毒,必须处理达标后才能排放,工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O。
+14H+=6Fe3++2Cr3++7H2O。①在该反应中还原产物是
②用单线桥标出该反应电子转移的方向和数目
您最近一年使用:0次
2022-03-19更新
|
150次组卷
|
2卷引用:海南省海口市第一中学2021-2022学年高一上学期12月月考化学试题



