名校
解题方法
1 . 现有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH 、Ba2+、CO
、Ba2+、CO 、Cl-、SO
、Cl-、SO 。现取两份各200mL溶液进行如下实验:
。现取两份各200mL溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.7g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,以下推测正确的是
 、Ba2+、CO
、Ba2+、CO 、Cl-、SO
、Cl-、SO 。现取两份各200mL溶液进行如下实验:
。现取两份各200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.7g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,以下推测正确的是
A.一定存在NH 、CO 、CO 、SO 、SO ,一定不存在Ba2+、Cl- ,一定不存在Ba2+、Cl- |
B.一定存在NH 、CO 、CO 、Cl-、SO 、Cl-、SO ,可能存在K+ ,可能存在K+ |
C.若溶液中存在NH 、Cl-、CO 、Cl-、CO 、SO 、SO 、K+五种离子,则c(K+)>0.1mol·L-1 、K+五种离子,则c(K+)>0.1mol·L-1 |
D.c(SO )=0.1mol·L-1,c(NH )=0.1mol·L-1,c(NH )<c(SO )<c(SO ) ) |
您最近一年使用:0次
2023-11-11更新
|
275次组卷
|
3卷引用:天津市南开中学2023-2024学年高三上学期12月月考化学试题
2 . 某溶液中可能含有K+、 、Fe2+、Al3+、Cl-、
、Fe2+、Al3+、Cl-、 、
、 、
、 中的若干种离子(忽略和水的反应以及水的电离),离子浓度均为0.1 mol/L。某同学进行了如下实验,下列说法正确的是
中的若干种离子(忽略和水的反应以及水的电离),离子浓度均为0.1 mol/L。某同学进行了如下实验,下列说法正确的是
 、Fe2+、Al3+、Cl-、
、Fe2+、Al3+、Cl-、 、
、 、
、 中的若干种离子(忽略和水的反应以及水的电离),离子浓度均为0.1 mol/L。某同学进行了如下实验,下列说法正确的是
中的若干种离子(忽略和水的反应以及水的电离),离子浓度均为0.1 mol/L。某同学进行了如下实验,下列说法正确的是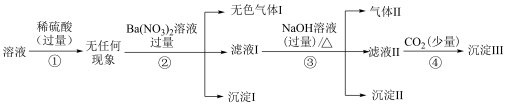
| A.沉淀Ⅰ一定有BaSO4,可能含有BaCO3 | B.沉淀Ⅲ具有两性 |
C.溶液中一定有 、Fe2+、Cl-、 、Fe2+、Cl-、 | D.需要通过焰色试验确定是否含有K+ |
您最近一年使用:0次
名校
3 . 某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子。该小组同学取部分水样进行实验。
中的若干种离子。该小组同学取部分水样进行实验。
①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;
②再滴加足量稀盐酸,沉淀部分溶解;
③最后滴加硝酸银溶液,又产生白色沉淀。
下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子。该小组同学取部分水样进行实验。
中的若干种离子。该小组同学取部分水样进行实验。①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;
②再滴加足量稀盐酸,沉淀部分溶解;
③最后滴加硝酸银溶液,又产生白色沉淀。
下列说法错误的是
A.溶液中一定有 | B.溶液中一定有 |
C.溶液中一定有 | D.溶液中一定有 |
您最近一年使用:0次
2023-11-10更新
|
277次组卷
|
6卷引用:黑龙江省牡丹江市第三高级中学2023-2024学年高三上学期第三次月考化学试卷
名校
解题方法
4 . 根据所学知识回答下列问题:
I.现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示:
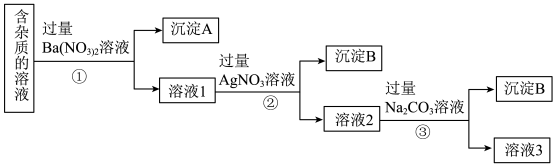
(1)沉淀A的主要成分是BaSO4和___________ (填化学式)。
(2)②中反应的离子方程式是___________ 。
(3)①②③中均进行的分离操作是___________ 。
(4)③中加入过量的Na2CO3溶液的目的是___________ 。
II.某河道两旁有甲、乙两厂,甲厂排放的工业废水中含有下列离子中的三种,乙厂的废水中含有下列离子中的另外三种。[已知:OH-与Ag+不能共存,AgCl和Fe(OH)3均为沉淀]
(5)经检测,甲厂的废水明显呈碱性,故甲厂废水中所含的离子为___________ 。
(6)如果在乙厂的废水中加一定量的铁粉,可以回收其中的金属___________ (填写金属的元素符号),此反应的离子方程式为___________ 。
I.现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示:

(1)沉淀A的主要成分是BaSO4和
(2)②中反应的离子方程式是
(3)①②③中均进行的分离操作是
(4)③中加入过量的Na2CO3溶液的目的是
II.某河道两旁有甲、乙两厂,甲厂排放的工业废水中含有下列离子中的三种,乙厂的废水中含有下列离子中的另外三种。[已知:OH-与Ag+不能共存,AgCl和Fe(OH)3均为沉淀]
| 阳离子 | K+、Ag+、Fe3+ |
| 阴离子 | Cl-、OH-、 |
(5)经检测,甲厂的废水明显呈碱性,故甲厂废水中所含的离子为
(6)如果在乙厂的废水中加一定量的铁粉,可以回收其中的金属
您最近一年使用:0次
2023-11-07更新
|
171次组卷
|
2卷引用:四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题
5 . 某白色固体混合物由NaOH、 、
、 、
、 中的两种物质组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加少量盐酸,产生白色沉淀。根据实验现象判断其组成为
中的两种物质组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加少量盐酸,产生白色沉淀。根据实验现象判断其组成为
 、
、 、
、 中的两种物质组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加少量盐酸,产生白色沉淀。根据实验现象判断其组成为
中的两种物质组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加少量盐酸,产生白色沉淀。根据实验现象判断其组成为A. 、 、 | B. 、 、 |
C.NaOH、 | D.NaOH、 |
您最近一年使用:0次
2023-11-05更新
|
114次组卷
|
2卷引用:黑龙江省齐齐哈尔普高联谊校2023-2024学年高三上学期11月期中考试化学试题
11-12高一上·辽宁铁岭·阶段练习
名校
解题方法
6 . 甲、乙两种溶液中分别含有大量的 、
、 、
、 、
、 、
、 、
、 这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
 、
、 、
、 、
、 、
、 、
、 这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是A. 、 、 、 、 | B. 、 、 、 、 |
C. 、 、 、 、 | D. 、 、 、 、 |
您最近一年使用:0次
2023-11-04更新
|
774次组卷
|
88卷引用:2014高考化学二轮复习限时集训 专题4离子反应练习卷
(已下线)2014高考化学二轮复习限时集训 专题4离子反应练习卷(已下线)2014高考化学专题突破训练 专题3氧化还原反应 离子反应练习卷(已下线)2015届北京市第66中学高三上学期第一次质量检测化学试卷2016届陕西省西北农林科技大学附属中学高三上学期期中化学试卷甘肃省会宁县第四中学2018届高三上学期期中考试化学试题2019年秋高三化学复习强化练习——离子反应夯基提能2020届高三化学选择题对题专练——离子反应的实际应用(已下线)微专题06 “四点”破解离子共存-备战2022年高考化学考点微专题(已下线)2011-2012年辽宁省开原高中高一上学期第一次考试化学试卷(已下线)2011-2012学年湖北省黄冈中学高一上学期期中考试化学试卷(已下线)2012-2013学年广东省汕头市金山中学高一下学期期末考试化学试卷(已下线)2013-2014学年河南省中原名校高一上学期期末联考化学试卷2014-2015福建省八县一中高一上学期期末考试化学试卷2015-2016学年陕西西安第一中学高一上期中考试化学试卷2015-2016学年湖南常德石门第一中学高一上期中化学试卷2015-2016学年江西省丰城中学高一上学期期中考试化学试卷2015-2016学年湖北省襄阳市四校高一上学期期中联考化学试卷2015-2016学年河南省滑县实验学校高一上学期期中测试化学试卷2015-2016学年江西省上饶县中学高一上学期第二次月考化学试卷2015-2016学年陕西省西安一中高一上学期期末化学试卷2015-2016学年广东省汕头金山中学高一上期末化学试卷2015-2016学年西藏日喀则高级中学高一下4月月考化学卷2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷2016-2017学年甘肃省庆阳一中高一上期中化学卷2016-2017学年河北省定州中学高一上期中化学试卷2016-2017学年辽宁省庄河市高级中学高一上学期期末考试化学试卷2016-2017学年贵州省都匀第一中学高一(3月)开学质检化学试卷北京市昌平临川育人学校2017-2018学年高一上学期期中考试化学试题天津市静海县第一中学、杨村一中、宝坻一中等六校2017-2018学年高一上学期期中联考化学试题广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一3月月考化学试题陕西省咸阳市2017-2018学年高一上学期期末考试化学试题(已下线)【走进新高考】(人教版必修一)第二章 化学物质及其变化 单元练习01甘肃省临泽县第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2018-2019学年高一上学期期中考试化学试题甘肃省镇原县第二中学2017-2018学年高一上学期期中考试化学试题吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷河南省辉县市第一高级中学2019-2020学年高一10月月考化学试题新疆沙雅县第二中学2018-2019学年高一上学期期中考试化学试题宁夏回族自治区石嘴山市第三中学2019-2020学年高一上学期期中考试化学试题四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题湖北省武汉市钢城第四中学2019-2020学年高一上学期期中考试化学试题云南省普洱市墨江县民族学校2019—2020学年高一上学期期末考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题天津市2019-2020学年高一年级下学期第一次月考化学试题吉林省长春市第二实验中学2019-2020学年高二下学期期末考试化学试题安徽省宣城市郎溪县郎溪中学2020-2021学年高一第一次月考化学试题云南省弥勒市第一中学2020-2021学年高一上学期第一次月考化学试题辽宁省协作校2020-2021学年高一上学期第一次联考化学试题黑龙江省绥化市明水县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】37广东省东莞市粤华学校2019-2020学年高一上学期期中考试化学试题(已下线)【浙江新东方】hzomo化学001安徽省黄山市屯溪第一中学2020-2021学年高一上学期期中考试化学试题四川省泸州市泸县第二中学2020-2021学年高一上学期期中考试化学试题甘肃省天水市秦安县第一中学2019-2020学年高一上学期期末考试化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期期中考试化学试题河北省石家庄市第二中学2020-2021学年高一上学期期中模拟试题(已下线)专题卷一 离子反应(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)天津市第二中学2021-2022学年高一上学期第一次月考化学试题湖南省长沙市雅礼中学2021-2022学年高一上学期第一次月考化学试题吉林省长春北师大附属学校2021-2022学年高一上学期第一次月考化学试题吉林省梅河口市第五中学2021-2022学年高一上学期第一次月考化学试题【石家庄新东方】2021-2022石家庄28中高一化学10月月考湖南省桂阳县展辉学校2021-2022学年高一上学期第一次段考化学试题(已下线)易错专题06 离子共存判断-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)陕西省西安市第一中学2021-2022学年高一上学期期中考试化学试题四川省绵阳第一中学2021-2022学年高一上学期期中教学质量测试化学试题黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期中学业阶段性评价考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一上学期9月月考化学试题辽宁省辽河油田第一高级中学2021-2022学年高一(甲部)上学期11月考化学试题江西省奉新县部分学校2021-2022学年高一上学期第二次月考化学试题陕西省西安交通大学附属中学2022-2023年高一上学期第一次月考化学试题浙江省台州市书生中学2022-2023学年高一上学期第一次月考化学试题湖南省长沙市雅礼中学2022-2023学年高一上学期第一次月考化学试题湖北省襄阳四中2021-2022学年高一上学期10月考试化学试题湖南省衡阳市田家炳实验中学2022-2023学年高一上学期期中考试化学试题黑龙江省哈尔滨市香坊区第九中学校2021-2022学年高一上学期期中考试化学试题云南省 景东彝族自治县第一中学2022-2023学年高一下学期期末考试化学试题山东省实验中学2022-2023学年高一上学期12月月考化学试题江苏省常熟市2023-2024学年高一上学期学生暑期自主学习调查化学试题天津市耀华中学2023-2024学年高一上学期第一次月考化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期期中考试化学试题云南省昆明市第三中学2023-2024学年高一上学期11月期中联考化学试题云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题天津市静海区第一中学2023-2024学年高一上学期10月月考化学试题四川省广安市华蓥中学2023-2024学年高一上学期12月月考化学试题河南省许昌市2023-2024学年高一上学期2月期末教学质量检测化学试题
7 . 有一包白色固体,可能含有 、
、 、KCl、
、KCl、 和无水
和无水 ,按下列步骤做实验:
,按下列步骤做实验:
①将该白色固体溶于水,得到无色溶液;
②向所得的无色溶液中加入足量 溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。
溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。
回答下列问题:
(1)该白色固体中一定存在的物质是___________ ,一定不存在的物质是___________ ,可能存在的物质是___________ 。
(2)称取该白色固体3.53 g,将其溶于水得到溶液A,在A中加入50 mL未知的 溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。
溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。
①该白色固体中 的质量分数为
的质量分数为___________ (保留2位有效数字,下同)。
② 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为___________ 。
③该白色固体的成分是___________ 。
 、
、 、KCl、
、KCl、 和无水
和无水 ,按下列步骤做实验:
,按下列步骤做实验:①将该白色固体溶于水,得到无色溶液;
②向所得的无色溶液中加入足量
 溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。
溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。回答下列问题:
(1)该白色固体中一定存在的物质是
(2)称取该白色固体3.53 g,将其溶于水得到溶液A,在A中加入50 mL未知的
 溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。
溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。①该白色固体中
 的质量分数为
的质量分数为②
 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为③该白色固体的成分是
您最近一年使用:0次
2023-11-03更新
|
195次组卷
|
3卷引用:甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题
甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题(已下线) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试练习题山东省聊城市临清市第一中学2023-2024学年高一上学期期末模拟考试化学试题
名校
8 . 已知反应: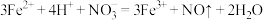 。有一澄清透明的溶液,只可能含有大量的Ce3+、Fe2+、H+、HSO
。有一澄清透明的溶液,只可能含有大量的Ce3+、Fe2+、H+、HSO 、SO
、SO 、Al3+、HCO
、Al3+、HCO 、CO
、CO 、NO
、NO 九种离子中的几种,向该溶液中,逐滴滴入一定体积NaOH溶液,一段时间后才产生沉淀。则下列判断正确的是
九种离子中的几种,向该溶液中,逐滴滴入一定体积NaOH溶液,一段时间后才产生沉淀。则下列判断正确的是
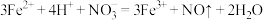 。有一澄清透明的溶液,只可能含有大量的Ce3+、Fe2+、H+、HSO
。有一澄清透明的溶液,只可能含有大量的Ce3+、Fe2+、H+、HSO 、SO
、SO 、Al3+、HCO
、Al3+、HCO 、CO
、CO 、NO
、NO 九种离子中的几种,向该溶液中,逐滴滴入一定体积NaOH溶液,一段时间后才产生沉淀。则下列判断正确的是
九种离子中的几种,向该溶液中,逐滴滴入一定体积NaOH溶液,一段时间后才产生沉淀。则下列判断正确的是| A.溶液中可能含有Fe2+ | B.溶液中可能含有SO 、HCO 、HCO |
| C.溶液中一定不含Al3+ | D.溶液中一定含有NO |
您最近一年使用:0次
2023-11-01更新
|
81次组卷
|
2卷引用:重庆市第八中学校2022届高三下学期高考适应性月考(七)化学试题
解题方法
9 . 40mLX溶液中可能含有下列离子中的若干种:Na+、 、Mg2+、Fe3+、Al3+、Cl-、
、Mg2+、Fe3+、Al3+、Cl-、 。现对X溶液进行如图所示实验,其现象和结果如图。下列说法正确的是
。现对X溶液进行如图所示实验,其现象和结果如图。下列说法正确的是

 、Mg2+、Fe3+、Al3+、Cl-、
、Mg2+、Fe3+、Al3+、Cl-、 。现对X溶液进行如图所示实验,其现象和结果如图。下列说法正确的是
。现对X溶液进行如图所示实验,其现象和结果如图。下列说法正确的是
A.X溶液中一定含有Mg2+、Al3+、Cl-,不含有Na+和 |
| B.X溶液中一定含有Na+、Mg2+、Cl-,可能含有Al3+ |
| C.X溶液中一定含有Na+,且c(Na+)为1.50mol/L |
| D.X溶液中c(Mg2+)为0.50mol/L、c(Al3+)为0.250mol/L |
您最近一年使用:0次
名校
解题方法
10 . 工业上用铁粉还原AgCl制取银,某小组探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如图:
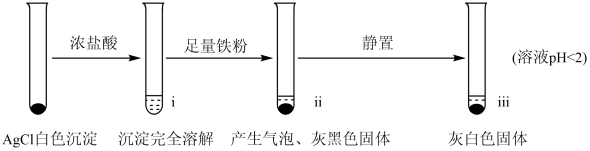
【资料】①AgCl+Cl- AgCl
AgCl
②2Fe3++4Cl- FeCl
FeCl
(1)检验ii中产物
①取ii中上层清液,滴加_______ 溶液,产生蓝色沉淀,说明溶液中含有Fe2+。
②取ii中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入稀硝酸溶解,再加入NaCl溶液生成_______ (填实验现象),证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
(2)检验iii中产物。
①取iii中灰白色固体,洗涤。进行如图实验,确认灰白色固体中含AgCl:
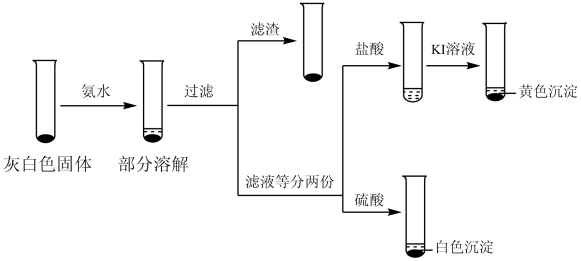
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请写出滤液加盐酸的离子方程式:_______ 。
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如表。
用离子方程式表示溶液变红的原因_______ ,Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
(3)小组同学认为O2可以直接氧化Ag继而生成AgCl,对此设计实验验证:_______ 。结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与Fe3+有关。
(4)实验A中的3~5,i中AgCl溶解,iii中又生成AgCl的原因是:_______ 。
(5)实验反思:铁粉还原AgCl制取银时应控制_______ 等因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如图:

【资料】①AgCl+Cl-
 AgCl
AgCl
②2Fe3++4Cl-
 FeCl
FeCl
(1)检验ii中产物
①取ii中上层清液,滴加
②取ii中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入稀硝酸溶解,再加入NaCl溶液生成
(2)检验iii中产物。
①取iii中灰白色固体,洗涤。进行如图实验,确认灰白色固体中含AgCl:

滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请写出滤液加盐酸的离子方程式:
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如表。
| 取样时间 | 10分钟 | 12小时 | 24小时 |
| 溶液颜色 | 浅红色 | 红色 | 深红色 |
 Fe(SCN)3。
Fe(SCN)3。(3)小组同学认为O2可以直接氧化Ag继而生成AgCl,对此设计实验验证:
(4)实验A中的3~5,i中AgCl溶解,iii中又生成AgCl的原因是:
(5)实验反思:铁粉还原AgCl制取银时应控制
您最近一年使用:0次



