名校
解题方法
1 . 某固体粉末中可能含有 、
、 、
、 、
、 、
、 、FeO、
、FeO、 中的若干种,某同学为确定该固体粉末的成分,进行连续实验:首先取少量固体溶于足量水,有固体未溶解;过滤,取滤液做焰色试验,有黄色火焰,透过蓝色钴玻璃未发现紫色;另取滤液两份,一份加盐酸有无色气体生成,遇空气变为红棕色,另一份加盐酸酸化的
中的若干种,某同学为确定该固体粉末的成分,进行连续实验:首先取少量固体溶于足量水,有固体未溶解;过滤,取滤液做焰色试验,有黄色火焰,透过蓝色钴玻璃未发现紫色;另取滤液两份,一份加盐酸有无色气体生成,遇空气变为红棕色,另一份加盐酸酸化的 溶液,产生白色沉淀;滤渣中加盐酸后完全溶解,滴加KSCN溶液无现象,通入
溶液,产生白色沉淀;滤渣中加盐酸后完全溶解,滴加KSCN溶液无现象,通入 ,溶液变红色。下列说法正确的是
,溶液变红色。下列说法正确的是
 、
、 、
、 、
、 、
、 、FeO、
、FeO、 中的若干种,某同学为确定该固体粉末的成分,进行连续实验:首先取少量固体溶于足量水,有固体未溶解;过滤,取滤液做焰色试验,有黄色火焰,透过蓝色钴玻璃未发现紫色;另取滤液两份,一份加盐酸有无色气体生成,遇空气变为红棕色,另一份加盐酸酸化的
中的若干种,某同学为确定该固体粉末的成分,进行连续实验:首先取少量固体溶于足量水,有固体未溶解;过滤,取滤液做焰色试验,有黄色火焰,透过蓝色钴玻璃未发现紫色;另取滤液两份,一份加盐酸有无色气体生成,遇空气变为红棕色,另一份加盐酸酸化的 溶液,产生白色沉淀;滤渣中加盐酸后完全溶解,滴加KSCN溶液无现象,通入
溶液,产生白色沉淀;滤渣中加盐酸后完全溶解,滴加KSCN溶液无现象,通入 ,溶液变红色。下列说法正确的是
,溶液变红色。下列说法正确的是| A.该固体粉末中含有钠、硫、铁元素,但不含钾、氮元素 |
B.该固体粉末中一定含有 、 、 、 、 ,不含 ,不含 、 、 |
C.该固体粉末中一定不含有 、 、 、 、 、 、 、 、 |
D.该固体粉末中可能含有 和 和 ,如需确定,还需另做实验 ,如需确定,还需另做实验 |
您最近一年使用:0次
昨日更新
|
84次组卷
|
3卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
解题方法
2 . 150mL某无色溶液中可能含有 中的若干种,现将此溶液分成三等份,进行如下实验:
中的若干种,现将此溶液分成三等份,进行如下实验:
①向第一份中加入足量的 稀盐酸,生成0.448L气体(已换算成标准状况下);
稀盐酸,生成0.448L气体(已换算成标准状况下);
②向第二份中加入足量NaOH溶液并加热,收集到0.04mol气体;
③向第三份中加入足量BaCl2溶液,得到沉淀6.27g,加入足量 稀盐酸充分反应后,剩余沉淀2.33g。
稀盐酸充分反应后,剩余沉淀2.33g。
根据上述实验,回答下列问题:
(1)用12mol·L-1的浓盐酸配制240mL0.5mol·L-1稀盐酸,需要用量筒量取___________ mL浓盐酸,若在量取浓盐酸时俯视刻度线,则会导致配制的稀盐酸的浓度___________ (填“偏高”、“偏低”或“不变”)。
(2)实验②中生成气体的离子方程式为___________ 。
(3)实验③中沉淀部分溶解的化学方程式为___________ ,剩余沉淀的化学式为___________ 。
(4)原溶液中
___________ 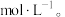
(5)经分析,溶液中一定存在Na+,理由是___________ 。
 中的若干种,现将此溶液分成三等份,进行如下实验:
中的若干种,现将此溶液分成三等份,进行如下实验:①向第一份中加入足量的
 稀盐酸,生成0.448L气体(已换算成标准状况下);
稀盐酸,生成0.448L气体(已换算成标准状况下);②向第二份中加入足量NaOH溶液并加热,收集到0.04mol气体;
③向第三份中加入足量BaCl2溶液,得到沉淀6.27g,加入足量
 稀盐酸充分反应后,剩余沉淀2.33g。
稀盐酸充分反应后,剩余沉淀2.33g。根据上述实验,回答下列问题:
(1)用12mol·L-1的浓盐酸配制240mL0.5mol·L-1稀盐酸,需要用量筒量取
(2)实验②中生成气体的离子方程式为
(3)实验③中沉淀部分溶解的化学方程式为
(4)原溶液中

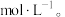
(5)经分析,溶液中一定存在Na+,理由是
您最近一年使用:0次
名校
3 . 某学习小组欲利用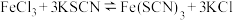 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将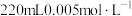
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变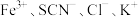 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取2mL溶液X,加入5滴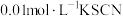 溶液,溶液红色
溶液,溶液红色_______ (填“变深”、“变浅”或“不变”,下同):取2mL溶液X,插入经砂纸打磨过的铁丝,溶液红色_______ 。
(2)取2mL溶液X,加入5滴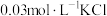 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是_______ 或者不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。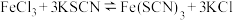 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响_______ ,二是_______ 。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:_______ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响
平衡体系产生的影响
资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应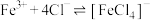 。
。
(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②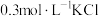 溶液、溶液、③
溶液、溶液、③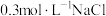 溶液、④
溶液、④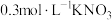 溶液、⑤
溶液、⑤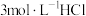 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。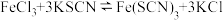 平衡体系的实验组是
平衡体系的实验组是____ ,盐效应影响较大的阳离子是_______ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:_______ 。
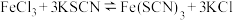 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将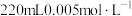
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
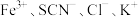 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取2mL溶液X,加入5滴
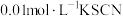 溶液,溶液红色
溶液,溶液红色(2)取2mL溶液X,加入5滴
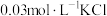 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
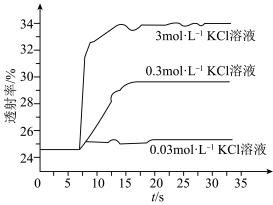
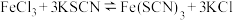 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。猜想②:
 产生的影响。
产生的影响。猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响
平衡体系产生的影响资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在
 溶液中存在反应
溶液中存在反应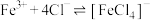 。
。(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②
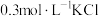 溶液、溶液、③
溶液、溶液、③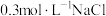 溶液、④
溶液、④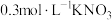 溶液、⑤
溶液、⑤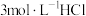 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。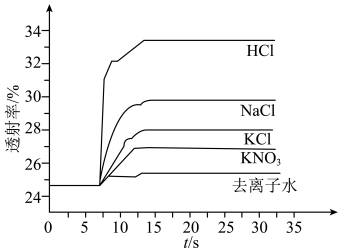
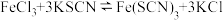 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:
您最近一年使用:0次
4 . 实验过程应根据具体的实验情况进行灵活设计,实验室为了提纯某粗盐样品(含有 、
、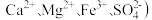 获得精盐,设计的具体步骤如下:
获得精盐,设计的具体步骤如下:
I.称取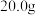 粗盐样品,加入
粗盐样品,加入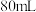 蒸馏水溶解。
蒸馏水溶解。
II.加入 溶液
溶液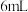 ,产生白色沉淀,加热
,产生白色沉淀,加热 ,使沉淀颗粒长大以易于沉淀。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液I。
,使沉淀颗粒长大以易于沉淀。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液I。
Ⅲ.将滤液1转移至200mL烧杯中,并加热至近沸,边搅拌,边滴加饱和Na2CO3溶液,直到不生成沉淀为止,再多加 饱和
饱和 溶液,静置。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液2。
溶液,静置。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液2。
Ⅳ.将滤液2转移至200mL烧杯中,滴加6mol/LHCl溶液,加热搅拌,调整溶液pH为3左右。
 .将调整
.将调整 后的溶液蒸发到原体积的三分之一,冷却结晶,减压过滤,然后洗涤晶体、抽干。烘干产品,得到精盐。
后的溶液蒸发到原体积的三分之一,冷却结晶,减压过滤,然后洗涤晶体、抽干。烘干产品,得到精盐。
回答下列问题:
(1)步骤I用到的玻璃仪器有烧杯、玻璃棒、_______ (填名称)和酒精灯。为保证充分溶解,采取的操作是_______ 、搅拌。
(2)步骤II确定沉淀完全的方法是_______ 。
(3)步骤III沉淀 的离子反应方程式为
的离子反应方程式为_______ ,若检验到滤液2中 未除尽,可以继续滴加合适浓度的
未除尽,可以继续滴加合适浓度的_______ 溶液加以除去。
(4)步骤IV中“加热搅拌”的目的是_______ 。
(5)步㵵V洗涤晶体可选用下列_______ 试剂(填标号),采用冷却结晶面不采取蒸发结晶的原因是_______ 。
a.无水酒精 b.少量蒸馏水 c.四氯化碳 d.二硫化碳
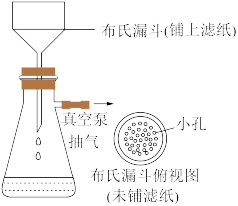
(6)减压过滤的装置如图所示,相比普通过滤的优点是_______ (写出2点)。
 、
、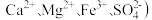 获得精盐,设计的具体步骤如下:
获得精盐,设计的具体步骤如下:I.称取
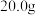 粗盐样品,加入
粗盐样品,加入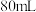 蒸馏水溶解。
蒸馏水溶解。II.加入
 溶液
溶液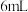 ,产生白色沉淀,加热
,产生白色沉淀,加热 ,使沉淀颗粒长大以易于沉淀。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液I。
,使沉淀颗粒长大以易于沉淀。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液I。Ⅲ.将滤液1转移至200mL烧杯中,并加热至近沸,边搅拌,边滴加饱和Na2CO3溶液,直到不生成沉淀为止,再多加
 饱和
饱和 溶液,静置。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液2。
溶液,静置。沉淀完全后,趁热减压过滤,弃去沉淀,得到滤液2。Ⅳ.将滤液2转移至200mL烧杯中,滴加6mol/LHCl溶液,加热搅拌,调整溶液pH为3左右。
 .将调整
.将调整 后的溶液蒸发到原体积的三分之一,冷却结晶,减压过滤,然后洗涤晶体、抽干。烘干产品,得到精盐。
后的溶液蒸发到原体积的三分之一,冷却结晶,减压过滤,然后洗涤晶体、抽干。烘干产品,得到精盐。回答下列问题:
(1)步骤I用到的玻璃仪器有烧杯、玻璃棒、
(2)步骤II确定沉淀完全的方法是
(3)步骤III沉淀
 的离子反应方程式为
的离子反应方程式为 未除尽,可以继续滴加合适浓度的
未除尽,可以继续滴加合适浓度的(4)步骤IV中“加热搅拌”的目的是
(5)步㵵V洗涤晶体可选用下列
a.无水酒精 b.少量蒸馏水 c.四氯化碳 d.二硫化碳
(6)减压过滤的装置如图所示,相比普通过滤的优点是
您最近一年使用:0次
解题方法
5 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①饱和氨水的浓度约为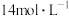
② 为浅青色沉淀
为浅青色沉淀
③ 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)有研究认为蓝色沉淀中还有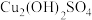 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。___________ ,c=___________ 。
②实验现象是___________ 。
(5)从平衡移动角度,结合化学用语,解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(6)针对实验ii未能成功配制 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:___________ 。
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、___________ 。
| 实验序号 | 操作 | 现象 | |
实验i: 的配制 的配制 | 实验i-a | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的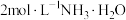 | 产生蓝色沉淀,加入 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的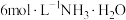 | 产生蓝色沉淀,加入 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的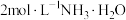 | 产生蓝色沉淀,加入 后沉淀完全溶解,得到澄清的深蓝色溶液。 后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii: 的配制 的配制 | 实验ii-a | 在试管内混合 溶液和过量 溶液和过量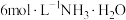 | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合 溶液和过量 溶液和过量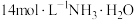 | 得到浅青色沉淀,沉淀未见明显溶解。 | |
实验iii: 的配制 的配制 | 实验iii | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的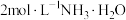 | 产生白色沉淀,加入 后沉淀完全溶解,得到无色溶液。 后沉淀完全溶解,得到无色溶液。 |
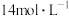
②
 为浅青色沉淀
为浅青色沉淀③
 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)有研究认为蓝色沉淀中还有
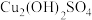 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测
 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。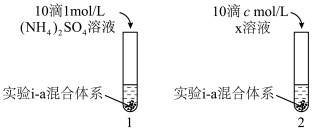
②实验现象是
(5)从平衡移动角度,结合化学用语,解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(6)针对实验ii未能成功配制
 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、
您最近一年使用:0次
6 . 已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液中的各一种。它们互相反应的情况如下表所示:
“↓”表示生成沉淀;“↑”表示产生气体;“-”表示无明显现象;“/”表示实验未做。
由上表可推知:c是___________ ,e是___________ (均填化学式)。
| a | b | c | d | e | |
| c | ↓ | ↓ | / | ↑ | - |
| b | ↓ | / | ↓ | - | - |
由上表可推知:c是
您最近一年使用:0次
解题方法
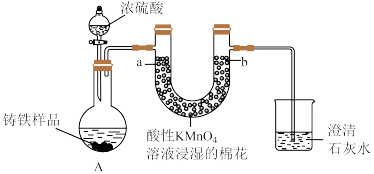
7 . Ⅰ.铸铁的主要成分为Fe和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。 、
、________ 。
(2)实验现象:①________ ,证明确实有SO2生成。
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明________ 。
(3)检测反应后A中所得溶液中含有 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加________ ,现象为________ 证明有 。
。
(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为________ 。
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将 还原为
还原为 的转化关系如下:
的转化关系如下:

(5)纳米Fe制备原理: ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是________ 。
(6)酸性条件下,纳米Fe和 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是________ 。
(7)检验溶液中 的操作和现象是
的操作和现象是________ 。
(8)溶液初始pH较低有利于 的去除,可能的原因是
的去除,可能的原因是________ (答1条)。
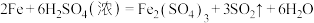 、
、(2)实验现象:①
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明
(3)检测反应后A中所得溶液中含有
 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加 。
。(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将
 还原为
还原为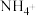 的转化关系如下:
的转化关系如下:
(5)纳米Fe制备原理:
 ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是(6)酸性条件下,纳米Fe和
 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是(7)检验溶液中
 的操作和现象是
的操作和现象是(8)溶液初始pH较低有利于
 的去除,可能的原因是
的去除,可能的原因是
您最近一年使用:0次
解题方法
8 . 某透明溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子(浓度均为
中的几种离子(浓度均为 )。常温下,对其进行如下实验操作:
)。常温下,对其进行如下实验操作:
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子(浓度均为
中的几种离子(浓度均为 )。常温下,对其进行如下实验操作:
)。常温下,对其进行如下实验操作: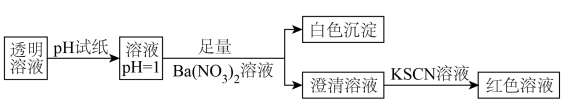
| A.实验过程中有氧化还原反应发生 |
B.无法判断原溶液中是否含有 |
C.原溶液中一定不含 、 、 、 、 、 、 、 、 、 、 |
D.原溶液中一定含有 、 、 、 、 、 、 |
您最近一年使用:0次
名校
9 . 黄色固体X,可能含有漂白粉、FeSO4、Fe2(SO4)3、CuCl2、KI之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是
| A.X中必有CuCl2,可能含有KI、FeSO4 |
| B.X中必有漂白粉和CuCl2而Fe2(SO4)3和FeSO4至少有一种 |
| C.Y中必有Cu(OH)2和Fe(OH)3,可能有I2 |
| D.用H2SO4酸化溶液Z,若有黄绿色气体放出,说明X中含有CuCl2 |
您最近一年使用:0次
名校
10 . 某固体粉末可能是由CaCO3、K2SO4、NaOH、Mg(NO3)2、Ba(NO3)2、KMnO4中的若干种物质组成,为确定其成分进行如下实验:①取适量样品放入水中并充分搅拌,然后过滤得到无色溶液与滤渣;②取少量滤渣置于足量稀硝酸中,滤渣部分溶解并有气体产生,下列说法中不正确的是
| A.固体粉末中不可能含有KMnO4 |
| B.向滤液中加入适量Fe粉,一定有气体生成 |
C.滤渣中可能含有 |
| D.滤渣部分溶解产生的气体不会形成酸雨 |
您最近一年使用:0次



