1 . 将锌粒放入含有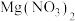 、
、 、
、 三种溶质的溶液中,充分反应后过滤,得到滤渣和滤液。以下是对滤渣或滤液成分的探究。
三种溶质的溶液中,充分反应后过滤,得到滤渣和滤液。以下是对滤渣或滤液成分的探究。
(1)请写出反应过程中一定发生反应的化学方程式____ 。
(2)若某次实验后小强对滤液中溶质的成分小强作出了以下猜想: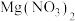 、
、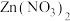 、
、 ,老师说小强的猜想不合理。请你写出该猜想不合理的原因
,老师说小强的猜想不合理。请你写出该猜想不合理的原因________ 。
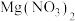 、
、 、
、 三种溶质的溶液中,充分反应后过滤,得到滤渣和滤液。以下是对滤渣或滤液成分的探究。
三种溶质的溶液中,充分反应后过滤,得到滤渣和滤液。以下是对滤渣或滤液成分的探究。(1)请写出反应过程中一定发生反应的化学方程式
(2)若某次实验后小强对滤液中溶质的成分小强作出了以下猜想:
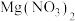 、
、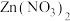 、
、 ,老师说小强的猜想不合理。请你写出该猜想不合理的原因
,老师说小强的猜想不合理。请你写出该猜想不合理的原因
您最近一年使用:0次
解题方法
2 . 化学是一门以实验为基础的学科,化学实验是开展化学研究的重要手段.
(1)检验物质的常用方法有显色法、沉淀法、气体法等。下列物质检验的方法中,不合理的是______ 。
(2)下列物质的分离与提纯的方法中,与物质的溶解度无关的是______ 。
(3)不能用于鉴别Na2CO3和KCl溶液的试剂或方法是______ 。
(4)下列各组溶液中,不用其他试剂就可鉴别的是______ 。
(5)下列检验某无色溶液样品中所含离子的实验,正确的是______ 。
(6)下列关于从碘水中萃取碘的实验中,说法正确的是______ 。
(7)某溶液中存在SO 和Cl-两种负离子,使用以下操作进行检验:①滴加足量的BaCl2溶液;②滴加足量的Ba(NO3)2溶液;③过滤;④加足量的盐酸:⑤滴加AgNO3溶液。正确的操作及顺序是
和Cl-两种负离子,使用以下操作进行检验:①滴加足量的BaCl2溶液;②滴加足量的Ba(NO3)2溶液;③过滤;④加足量的盐酸:⑤滴加AgNO3溶液。正确的操作及顺序是______ 。
(8)某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如表所示,回答:
①三次检测结果中第______ 次检测结果肯定不正确。
②在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:
第一步:向溶液中滴加过量的______ 溶液(填化学式),其目的是检验CO 并将其除去。
并将其除去。
第二步:加入______ 溶液(填化学式),其目的是______ 。
第三步:过滤,再向滤液中加入______ 溶液(填化学式),其目的是______ 。
(1)检验物质的常用方法有显色法、沉淀法、气体法等。下列物质检验的方法中,不合理的是
| A.酸性溶液:显色法 | B.I2:显色法 |
| C.Cl-:沉淀法 | D.Ca2+:气体法 |
| A.过滤 | B.萃取 | C.结晶 | D.蒸馏 |
| A.盐酸 | B.BaCl2溶液 | C.AgNO3溶液 | D.焰色反应 |
| A.HCl、CuCl2、NaNO3、Na2SO4 |
| B.Na2CO3、Na2SO4、HCl、H2SO4 |
| C.FeCl3、Na2SO4、NaCl、NaOH |
| D.BaCl2、Na2CO3、HCl、NaNO3 |
| A.加AgNO3溶液,生成白色沉淀,可确定有Cl-存在 |
B.加足量稀盐酸,产生无色的气体,可确定有CO 存在 存在 |
C.加足量稀盐酸,无明显现象,再加BaCl2溶液,生成白色沉淀,可确定有SO 存在 存在 |
| D.用洁净的铂丝蘸取溶液,在火焰上灼烧焰色为黄色,可确定含Na+,不含K+ |
| A.萃取剂不能溶于水,且比水更容易使碘溶解 |
| B.注入碘水和萃取剂,倒转分液漏斗反复用力振荡后即可分液 |
| C.萃取时,选用萃取剂的密度必须比水大 |
| D.若没有四氯化碳,可用酒精代替 |
 和Cl-两种负离子,使用以下操作进行检验:①滴加足量的BaCl2溶液;②滴加足量的Ba(NO3)2溶液;③过滤;④加足量的盐酸:⑤滴加AgNO3溶液。正确的操作及顺序是
和Cl-两种负离子,使用以下操作进行检验:①滴加足量的BaCl2溶液;②滴加足量的Ba(NO3)2溶液;③过滤;④加足量的盐酸:⑤滴加AgNO3溶液。正确的操作及顺序是| A.①③⑤ | B.②④③⑤ | C.②③⑤ | D.⑤③① |
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
②在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:
第一步:向溶液中滴加过量的
 并将其除去。
并将其除去。第二步:加入
第三步:过滤,再向滤液中加入
您最近一年使用:0次
解题方法
3 . 已知:碳酸氢钠和硫酸氢钠电离方程式为:NaHCO3=Na++HCO ,NaHSO4=Na++H++SO
,NaHSO4=Na++H++SO 。根据以上信息,请按要求完成下列问题。
。根据以上信息,请按要求完成下列问题。
(1)将下列化学反应方程式改成离子反应方程式。
①NaHCO3+NaOH=Na2CO3+H2O离子反应方程式:___________ 。
②NaHCO3+NaHSO4=Na2SO4+CO2↑+H2O离子反应方程式:___________ 。
(2)现有失去标签的三瓶无色溶液A、B、C,只知它们是K2CO3溶液、NaHSO4溶液和Ba(NO3)2溶液,为鉴别它们,进行如下实验。
①A+B 溶液+气体;
溶液+气体;
②A+C 溶液+沉淀;
溶液+沉淀;
③B+C 溶液+沉淀;
溶液+沉淀;
④将②得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体。
根据以上实验事实,则A为___________ 溶液,B为___________ 溶液,C为___________ 溶液。
 ,NaHSO4=Na++H++SO
,NaHSO4=Na++H++SO 。根据以上信息,请按要求完成下列问题。
。根据以上信息,请按要求完成下列问题。(1)将下列化学反应方程式改成离子反应方程式。
①NaHCO3+NaOH=Na2CO3+H2O离子反应方程式:
②NaHCO3+NaHSO4=Na2SO4+CO2↑+H2O离子反应方程式:
(2)现有失去标签的三瓶无色溶液A、B、C,只知它们是K2CO3溶液、NaHSO4溶液和Ba(NO3)2溶液,为鉴别它们,进行如下实验。
①A+B
 溶液+气体;
溶液+气体;②A+C
 溶液+沉淀;
溶液+沉淀;③B+C
 溶液+沉淀;
溶液+沉淀;④将②得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体。
根据以上实验事实,则A为
您最近一年使用:0次
名校
解题方法
4 . NaCl溶液中混有Na2CO3、Na2SO4,为检验两种物质的存在,你先后需要的试剂有___________ 溶液、澄清石灰水和___________ 溶液,请按实验先后顺序写出相应的离子方程式:___________ 、 ___________ 、___________ 。
您最近一年使用:0次
名校
5 . 在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。
(1)实验Ⅰ的现象为______ 。
(2)实验Ⅱ的现象中能证明 发生反应而Cu2+不发生反应的实验现象是
发生反应而Cu2+不发生反应的实验现象是______ 。
(3)实验Ⅲ的离子方程式为______ 。
(4)实验Ⅳ中Cu4(OH)xSO4中x=______ ,已知最终得到的溶液中Cu元素仅存在Cu(OH) 一种形式,若分离出蓝色沉淀并称量其质量为ag,则溶液中Cu(OH)
一种形式,若分离出蓝色沉淀并称量其质量为ag,则溶液中Cu(OH) 的物质的量浓度为
的物质的量浓度为______ (列出计算式)。
| 实验 | 试剂及操作 | 现象 | |
 1.0mL | 试管 | 滴管 | |
| 0.1mol·L−1H2SO4溶液 | 先滴加酚酞溶液,再滴加1.5mL0.2mol·L−1NaOH溶液 | Ⅰ.______ | |
| 0.1mol·L−1CuSO4溶液 | 滴加2mL0.1mol·L−1BaCl2溶液 | Ⅱ.______ | |
| 0.1mol·L−1FeCl2溶液 | 滴加5-6滴饱和NaHCO3溶液 | Ⅲ.产生绿色沉淀,并产生气泡 | |
| 0.1mol·L−1CuSO4溶液 | 持续滴加1.0mLNaOH溶液 | Ⅳ.先产生蓝色沉淀[主要成分Cu4(OH)xSO4],后沉淀部分溶解 | |
(1)实验Ⅰ的现象为
(2)实验Ⅱ的现象中能证明
 发生反应而Cu2+不发生反应的实验现象是
发生反应而Cu2+不发生反应的实验现象是(3)实验Ⅲ的离子方程式为
(4)实验Ⅳ中Cu4(OH)xSO4中x=
 一种形式,若分离出蓝色沉淀并称量其质量为ag,则溶液中Cu(OH)
一种形式,若分离出蓝色沉淀并称量其质量为ag,则溶液中Cu(OH) 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
解题方法
6 . 有以下物质:①氯气 ②铁 ③氯化铵 ④氢氧化钠 ⑤氯化钠 ⑥二氧化碳 ⑦醋酸⑧过氧化钠 ⑨碳酸氢钠 ⑩碳酸钠
(1)写出①在②中燃烧的化学方程式__________ 。
(2)写出④溶液与⑦溶液混合的离子方程式__________ 。
(3)写出电解熔融⑤的化学方程式__________ 。
(4)写出③在水溶液中的电离方程式 __________ ,检验其阳离子的实验方法对应的离子方程式为__________ 。
(5)选择以上物质按要求写出可以生成碳酸钠的化学方程式:
氧化还原反应__________
非氧化还原反应__________
(6)若有⑨和⑩两种固体混合物 ,加入足量的盐酸充分反应,可以得到
,加入足量的盐酸充分反应,可以得到 的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=
的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=__________ 。
(1)写出①在②中燃烧的化学方程式
(2)写出④溶液与⑦溶液混合的离子方程式
(3)写出电解熔融⑤的化学方程式
(4)写出③在水溶液中的
(5)选择以上物质按要求写出可以生成碳酸钠的化学方程式:
氧化还原反应
非氧化还原反应
(6)若有⑨和⑩两种固体混合物
 ,加入足量的盐酸充分反应,可以得到
,加入足量的盐酸充分反应,可以得到 的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=
的气体(标准状况),则该混合物中两种固体的物质的量比为⑨∶⑩=
您最近一年使用:0次
解题方法
7 . 在溶液中进行的化学反应通常是比较快的。所以在实验室或化工生产中,溶液的应用非常广泛。回答下列问题:
(1)实验室配制250mL NaOH溶液时应使用托盘天平称量NaOH固体的质量为
NaOH溶液时应使用托盘天平称量NaOH固体的质量为___________ g。下列配制过程中出现的情况,会使所配溶液浓度偏高的是___________ (填字母)。
A.溶解时,有少量溶液溅出 B.未恢复至室温就转移定容
C.定容时,俯视刻度线 D.未干燥容量瓶
现有一混合溶液,可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种,取两份各100mL该混合溶液进行如下实验。
中的若干种,取两份各100mL该混合溶液进行如下实验。
实验I:向第一份混合溶液中滴加上述配制的 的NaOH溶液,溶液中沉淀的质量与NaOH溶液的体积关系如图所示:
的NaOH溶液,溶液中沉淀的质量与NaOH溶液的体积关系如图所示:

实验II:先向第二份混合溶液中加入足量 溶液,无明显现象;再加入足量的
溶液,无明显现象;再加入足量的 溶液,产生白色沉淀。
溶液,产生白色沉淀。
已知: ,
, 。
。
(2)由实验I推断该混合溶液中一定存在___________ (填离子符号,下同),一定不存在___________ 。
(3)实验I图像ab段发生反应的离子方程式为___________ ;bc段参与反应的离子的物质的量为___________ 。
(4)某同学由实验II推断该混合溶液中一定存在 ,你是否同意该说法,说明理由:
,你是否同意该说法,说明理由:_____ 。
(5)若原混合溶液中不含 ,则原溶液中含有的阴离子为
,则原溶液中含有的阴离子为___________ ,其物质的量浓度为___________ 。
(1)实验室配制250mL
 NaOH溶液时应使用托盘天平称量NaOH固体的质量为
NaOH溶液时应使用托盘天平称量NaOH固体的质量为A.溶解时,有少量溶液溅出 B.未恢复至室温就转移定容
C.定容时,俯视刻度线 D.未干燥容量瓶
现有一混合溶液,可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种,取两份各100mL该混合溶液进行如下实验。
中的若干种,取两份各100mL该混合溶液进行如下实验。实验I:向第一份混合溶液中滴加上述配制的
 的NaOH溶液,溶液中沉淀的质量与NaOH溶液的体积关系如图所示:
的NaOH溶液,溶液中沉淀的质量与NaOH溶液的体积关系如图所示:
实验II:先向第二份混合溶液中加入足量
 溶液,无明显现象;再加入足量的
溶液,无明显现象;再加入足量的 溶液,产生白色沉淀。
溶液,产生白色沉淀。已知:
 ,
, 。
。(2)由实验I推断该混合溶液中一定存在
(3)实验I图像ab段发生反应的离子方程式为
(4)某同学由实验II推断该混合溶液中一定存在
 ,你是否同意该说法,说明理由:
,你是否同意该说法,说明理由:(5)若原混合溶液中不含
 ,则原溶液中含有的阴离子为
,则原溶液中含有的阴离子为
您最近一年使用:0次
名校
8 . 现有一包不纯的硫酸钠固体,可能含有 中的一种或几种。现进行如下实验:
中的一种或几种。现进行如下实验:
①取少量固体溶于足量水,过滤得白色固体A和无色滤液B;
②取固体 ,加入足量稀盐酸,固体完全溶解;
,加入足量稀盐酸,固体完全溶解;
③取少量滤液 ,滴加
,滴加 溶液,无明显现象;
溶液,无明显现象;
④另取少量滤液 ,先滴加过量稀硝酸,静置,再滴加
,先滴加过量稀硝酸,静置,再滴加 溶液,出现白色沉淀。
溶液,出现白色沉淀。
回答下列问题:
(1)上述列举的物质中,焰色反应呈黄色的是___________ (填化学式,下同)。
(2)由①②③可知,原固体一定不含___________ ,一定含___________ 。(填化学式)
(3)能否由④推知原固体一定含 ?
?________ 。如若不行,应该如何改进?________ 。
 中的一种或几种。现进行如下实验:
中的一种或几种。现进行如下实验:①取少量固体溶于足量水,过滤得白色固体A和无色滤液B;
②取固体
 ,加入足量稀盐酸,固体完全溶解;
,加入足量稀盐酸,固体完全溶解;③取少量滤液
 ,滴加
,滴加 溶液,无明显现象;
溶液,无明显现象;④另取少量滤液
 ,先滴加过量稀硝酸,静置,再滴加
,先滴加过量稀硝酸,静置,再滴加 溶液,出现白色沉淀。
溶液,出现白色沉淀。回答下列问题:
(1)上述列举的物质中,焰色反应呈黄色的是
(2)由①②③可知,原固体一定不含
(3)能否由④推知原固体一定含
 ?
?
您最近一年使用:0次
名校
9 . 对下列内容进行填空。
(1)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是___________ 。
(2)两个相同容积的密闭容器X、Y,在25℃下,X中充入ag A气体,Y中充入ag CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量为___________ 。
(3)某固体A在一定条件下加热分解,产物都是气体。分解的方程式为2A =B↑ + 2C↑ + 2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为___________ 。
(4)现有24 mL 浓度为0.1 mol/L Na2SO3溶液恰好与20 mL 浓度为0.04 mol/L KRO4 溶液完全转化为Na2SO4,则R元素在产物中的化合价是___________ 。
(5)碳酸钠样品中可能含有氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜五种杂质中的三种。现进行下列实验:①称取4.7g样品,加入足量水,样品部分溶解;②向①中所得悬浊液中加入100 mL 1 mol / L HCl ,最终得到无色澄清溶液,此过程中共产生0.04 mol气体;③向②中反应后的溶液中加入足量的硝酸银与稀硝酸,得到15.8 g白色沉淀。由此可知杂质中一定含有___________ (填写化学式)。
(1)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是
(2)两个相同容积的密闭容器X、Y,在25℃下,X中充入ag A气体,Y中充入ag CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量为
(3)某固体A在一定条件下加热分解,产物都是气体。分解的方程式为2A =B↑ + 2C↑ + 2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为
(4)现有24 mL 浓度为0.1 mol/L Na2SO3溶液恰好与20 mL 浓度为0.04 mol/L KRO4 溶液完全转化为Na2SO4,则R元素在产物中的化合价是
(5)碳酸钠样品中可能含有氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜五种杂质中的三种。现进行下列实验:①称取4.7g样品,加入足量水,样品部分溶解;②向①中所得悬浊液中加入100 mL 1 mol / L HCl ,最终得到无色澄清溶液,此过程中共产生0.04 mol气体;③向②中反应后的溶液中加入足量的硝酸银与稀硝酸,得到15.8 g白色沉淀。由此可知杂质中一定含有
您最近一年使用:0次
10 . 某溶液只含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子且各离子的浓度均相同。为确定具体离子种类(不考虑溶液中微量的离子),某同学进行了如下实验:
中的几种离子且各离子的浓度均相同。为确定具体离子种类(不考虑溶液中微量的离子),某同学进行了如下实验:
ⅰ.向 溶液中加入过量的
溶液中加入过量的 溶液,有白色沉淀产生,过滤、洗涤、干燥,所得沉淀的总质量为
溶液,有白色沉淀产生,过滤、洗涤、干燥,所得沉淀的总质量为 。
。
ⅱ.将ⅰ中沉淀加入足量稀盐酸中,沉淀完全消失,有气体产生,通过饱和 溶液并干燥后收集到纯净的气体a。
溶液并干燥后收集到纯净的气体a。
回答下列问题:
(1)ⅰ中生成的白色沉淀为_____ ;过滤使用到的玻璃仪器有玻璃棒、烧杯、_____ 。
(2)ⅱ中发生反应的离子方程式为_____ ,生成的气体的体积为_____ L(换算成标准状况)。
(3)该溶液中含有的离子为_____ (填离子符号),离子浓度均为_____  。
。
(4)相同条件下,等质量的气体a与 的体积比为
的体积比为_____ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子且各离子的浓度均相同。为确定具体离子种类(不考虑溶液中微量的离子),某同学进行了如下实验:
中的几种离子且各离子的浓度均相同。为确定具体离子种类(不考虑溶液中微量的离子),某同学进行了如下实验:ⅰ.向
 溶液中加入过量的
溶液中加入过量的 溶液,有白色沉淀产生,过滤、洗涤、干燥,所得沉淀的总质量为
溶液,有白色沉淀产生,过滤、洗涤、干燥,所得沉淀的总质量为 。
。ⅱ.将ⅰ中沉淀加入足量稀盐酸中,沉淀完全消失,有气体产生,通过饱和
 溶液并干燥后收集到纯净的气体a。
溶液并干燥后收集到纯净的气体a。回答下列问题:
(1)ⅰ中生成的白色沉淀为
(2)ⅱ中发生反应的离子方程式为
(3)该溶液中含有的离子为
 。
。(4)相同条件下,等质量的气体a与
 的体积比为
的体积比为
您最近一年使用:0次



