1 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。
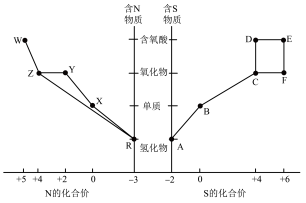
回答下列问题:
(1)写出物质R的电子式___________ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是___________ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是___________ 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 中所含化学键类型为
中所含化学键类型为___________ , 水溶液显
水溶液显___________ (填“酸性”、“碱性”或“中性”)。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: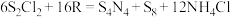 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有___________ ,该反应每生成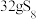 转移电子
转移电子___________ mol。

回答下列问题:
(1)写出物质R的电子式
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与
 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 中所含化学键类型为
中所含化学键类型为 水溶液显
水溶液显(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有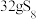 转移电子
转移电子
您最近一年使用:0次
2 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。

回答下列问题:
(1)写出物质R的电子式。_______ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是_______ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将 的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是_______ 。
(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 晶体中所含化学键的类型有
晶体中所含化学键的类型有_______ ,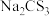 水溶液显
水溶液显_______ (填“酸性”、“碱性”或“中性”)。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: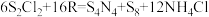 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有_______ ,该反应每生成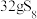 转移电子
转移电子_______  。其中被氧化的元素是
。其中被氧化的元素是_______ (填元素符号)。

回答下列问题:
(1)写出物质R的电子式。
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与
 溶液反应,都是酸性氧化物
溶液反应,都是酸性氧化物e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
(3)将
 的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
的物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是(4)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 晶体中所含化学键的类型有
晶体中所含化学键的类型有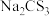 水溶液显
水溶液显(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: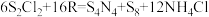 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有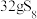 转移电子
转移电子 。其中被氧化的元素是
。其中被氧化的元素是
您最近一年使用:0次
名校
3 . 氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是
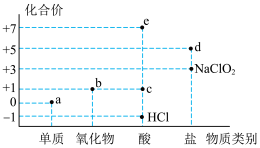
| A.c在光照条件下很容易分解 |
| B.b不是酸性氧化物,因为它没有对应的含氧酸 |
| C.图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 |
D.将a通入 溶液中,已知生成 溶液中,已知生成 、 、 和d的混合物,若 和d的混合物,若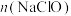 与 与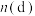 之比为 之比为 ,则氧化剂与还原剂的物质的量之比为 ,则氧化剂与还原剂的物质的量之比为 |
您最近一年使用:0次
2023-11-21更新
|
387次组卷
|
5卷引用:湖南省衡阳市衡南县第一次联考2023-2024学年高三上学期11月期中化学试题
名校
解题方法
4 . 如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:

(1)上述物质间的转化,属于固氮反应的有________ (填序号),A是否属于酸性氧化物_______ (填“是”或“否”)。
(2)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为________ 。
(3)工业上以B、空气、水为原料生产硝酸分为三步:其中第三步:NO2→HNO3,该反应中氧化剂与还原剂的物质的量之比为________ 。
(4)写出浓硝酸与木炭在加热条件下反应的化学方程式,并用单线桥表示其电子转移的情况_______ 。
(5)如图装置可用于探究氯气与氨气的反应,实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气。实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为_______ ,请设计一个实验方案鉴定该固体中的阳离子_______ 。

(6)有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0mol/L,c(HNO3)=1.0mol/L。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成A的体积为_______ L。

(1)上述物质间的转化,属于固氮反应的有
(2)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为
(3)工业上以B、空气、水为原料生产硝酸分为三步:其中第三步:NO2→HNO3,该反应中氧化剂与还原剂的物质的量之比为
(4)写出浓硝酸与木炭在加热条件下反应的化学方程式,并用单线桥表示其电子转移的情况
(5)如图装置可用于探究氯气与氨气的反应,实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气。实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为

(6)有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0mol/L,c(HNO3)=1.0mol/L。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成A的体积为
您最近一年使用:0次
2023高一下·上海嘉定·学业考试
名校
5 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
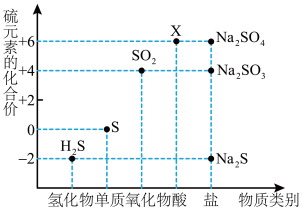
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
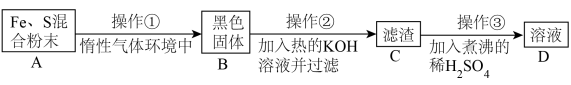
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
21-22高一上·山东临沂·期末
名校
解题方法
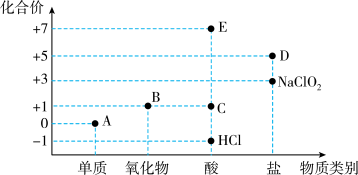
6 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
回答下列问题:
(1)已知D可用于实验室制O2,其焰色试验为紫色,D中含有的化学键有_______ ;A、B、C、D四种物质中,属于电解质的是_______ (填化学式)。
(2)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为_______ 。
(3)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为_______ 。
(4)已知A与氢氧化钠溶液反应生成NaCl、NaClO和NaClO3的混合物,若n(NaClO)与n(NaClO3)之比为3∶1,则氧化剂与还原剂的物质的量之比为______ 。
(5)NaClO2、二氧化氯(ClO2)均为高效无毒的消毒剂。
①NaClO2的消毒效率是A的_______ 倍(还原产物都是Cl-,消毒效率以单位物质的量的物质得到的电子数表示)。
②ClO2在杀菌消毒过程中会产生亚氯酸盐( ),需将其转化为Cl-除去,下列试剂可将
),需将其转化为Cl-除去,下列试剂可将 转化为Cl-的是
转化为Cl-的是_________ (填标号)。
A.FeSO4 B.O3 C.KMnO4 D.Na2SO3

回答下列问题:
(1)已知D可用于实验室制O2,其焰色试验为紫色,D中含有的化学键有
(2)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为
(3)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为
(4)已知A与氢氧化钠溶液反应生成NaCl、NaClO和NaClO3的混合物,若n(NaClO)与n(NaClO3)之比为3∶1,则氧化剂与还原剂的物质的量之比为
(5)NaClO2、二氧化氯(ClO2)均为高效无毒的消毒剂。
①NaClO2的消毒效率是A的
②ClO2在杀菌消毒过程中会产生亚氯酸盐(
 ),需将其转化为Cl-除去,下列试剂可将
),需将其转化为Cl-除去,下列试剂可将 转化为Cl-的是
转化为Cl-的是A.FeSO4 B.O3 C.KMnO4 D.Na2SO3
您最近一年使用:0次
2023-06-08更新
|
233次组卷
|
5卷引用:广东省深圳中学2023届高三上学期第一次阶段测试化学试题
7 . 如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
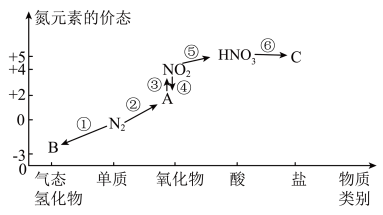
(1)上述物质间的转化,属于固氮反应的有___________ (填序号), 是否属于酸性氧化物
是否属于酸性氧化物__________ (填“是”或“否”)。
(2) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为______________ 。
(3)工业上以B、空气、水为原料生产硝酸分为三步:其中第三步: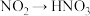 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为______________ 。
(4)写出浓硝酸与木炭在加热条件下反应的化学方程式,并用单线桥表示其电子转移的情况__________ 。
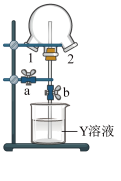
(5)如图装置可用于探究氯气与氨气的反应,实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气。实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为__________ ,请设计一个实验方案鉴定该固体中的阳离子________________ 。
(6)有一瓶稀硫酸和稀硝酸的混合溶液,其中 ,
, 。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成A的体积为
。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成A的体积为___________ L。

(1)上述物质间的转化,属于固氮反应的有
 是否属于酸性氧化物
是否属于酸性氧化物(2)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为(3)工业上以B、空气、水为原料生产硝酸分为三步:其中第三步:
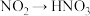 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(4)写出浓硝酸与木炭在加热条件下反应的化学方程式,并用单线桥表示其电子转移的情况
(5)如图装置可用于探究氯气与氨气的反应,实验时先通过三颈瓶瓶口1通入氨气,然后关闭b活塞,再通过瓶口2通入氯气。实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为

(6)有一瓶稀硫酸和稀硝酸的混合溶液,其中
 ,
, 。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成A的体积为
。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成A的体积为
您最近一年使用:0次
名校
解题方法
8 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,还原产物中Cr元素的化合价为_______ 。
(5)为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了如图所示的实验装置。

该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2.在此实验中,仪器F的作用是_______ ;发生装置B应选择如图三种装置中的_______ (填序号)。


(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,还原产物中Cr元素的化合价为
(5)为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了如图所示的实验装置。

该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2.在此实验中,仪器F的作用是

您最近一年使用:0次
2022-05-13更新
|
248次组卷
|
2卷引用:河北省衡水市深州中学2022-2023学年高三上学期第一次月考化学试题
名校
解题方法
9 . 下图是硫元素的常见化合价与部分含硫物质类别的对应关系图,下列说法正确的是


| A.X、Z都可以被W的浓溶液氧化 |
| B.W的浓溶液使胆矾变白,说明W的浓溶液具有脱水性 |
| C.Z具有漂白性,所以可以使溴水褪色 |
| D.X与Z反应时,氧化剂与还原剂物质的量之比为1:2 |
您最近一年使用:0次
2022-07-28更新
|
138次组卷
|
2卷引用:河南省南阳市社旗县第一高级中学2023-2024学年高三上学期1月月考化学试题
20-21高一下·浙江·期中
解题方法
10 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
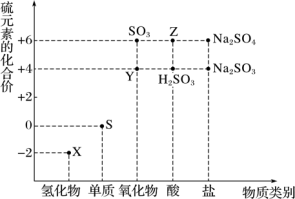
(1)将X与Y混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)Z 的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(3) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备 Na2S2O3的方案理论上可行的是_______ (填字母) 。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知 Na2SO3能被 K2Cr2O7氧化为Na2SO4,则 24 mL 0.05 mol·L-1的 Na2SO3溶液与 20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr 元素在还原产物中的化合价为_______ 。

(1)将X与Y混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(2)Z 的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(3) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备 Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(4)已知 Na2SO3能被 K2Cr2O7氧化为Na2SO4,则 24 mL 0.05 mol·L-1的 Na2SO3溶液与 20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr 元素在还原产物中的化合价为
您最近一年使用:0次



