名校
解题方法
1 . 100mL 6.0 mol·L-1稀硝酸,恰好使铜和氧化铜完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:(已知Cu:64;O:16)
(1)铜和稀硝酸反应的化学方程式:_______
(2)氧化铜和稀硝酸反应的化学方程式:_______
(3)原混合物中铜的物质的量为_______ ,氧化铜的质量为_______ 。
(1)铜和稀硝酸反应的化学方程式:
(2)氧化铜和稀硝酸反应的化学方程式:
(3)原混合物中铜的物质的量为
您最近一年使用:0次
2022-09-30更新
|
615次组卷
|
2卷引用:新疆哈密市第八中学2021-2022学年高一下学期期中考试化学试题
名校
2 . 在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况)。
(1)需要消耗MnO2________ 克。
(2)被氧化的HCl的物质的量是_________ 。
(1)需要消耗MnO2
(2)被氧化的HCl的物质的量是
您最近一年使用:0次
2022-03-20更新
|
305次组卷
|
3卷引用:新疆乌鲁木齐市第四中学2022-2023学年高一上学期期末考试化学试题
名校
3 . 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将含MnO2的质量为17.4g的软锰矿石与足量浓盐酸完全反应(杂质不参加反应)。计算:
MnCl2+Cl2↑+2H2O。现将含MnO2的质量为17.4g的软锰矿石与足量浓盐酸完全反应(杂质不参加反应)。计算:
(1)生成的Cl2的体积___________ (标准状况下)。
(2)参加反应的浓盐酸中被氧化HCl的物质的量___________ 。
 MnCl2+Cl2↑+2H2O。现将含MnO2的质量为17.4g的软锰矿石与足量浓盐酸完全反应(杂质不参加反应)。计算:
MnCl2+Cl2↑+2H2O。现将含MnO2的质量为17.4g的软锰矿石与足量浓盐酸完全反应(杂质不参加反应)。计算:(1)生成的Cl2的体积
(2)参加反应的浓盐酸中被氧化HCl的物质的量
您最近一年使用:0次
4 . 将40g铁粉放入600g稀硝酸中,若两者恰好完全反应,且稀硝酸被还原成NO,求:稀硝酸的质量分数___ 。
您最近一年使用:0次
5 . Ⅰ.如图所示,一密闭容器被无摩擦可滑动的两隔板a和b分成甲、乙两室。标准状况下,在乙室中充入0.6 mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9 g。

(1)甲室中NH3、H2的物质的量之比为___________ ,质量之比为___________ 。
(2)甲室中气体的物质的量为___________ mol。
(3)甲室中气体的质量为___________ g。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3完全反应后,活塞b将位于刻度“___________ ”处(填数字)。
Ⅱ.(1)向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是___________ 。
A. p=m+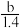 B.p=m+
B.p=m+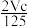 C.n=m+
C.n=m+ D. n=m+
D. n=m+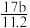
(2)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为___________ 。提示:①H2C2O4是二元弱酸 ②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O

(1)甲室中NH3、H2的物质的量之比为
(2)甲室中气体的物质的量为
(3)甲室中气体的质量为
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3完全反应后,活塞b将位于刻度“
Ⅱ.(1)向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A. p=m+
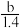 B.p=m+
B.p=m+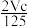 C.n=m+
C.n=m+ D. n=m+
D. n=m+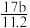
(2)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
您最近一年使用:0次
6 . 铜与稀硝酸反应,生成标准状况下2.24升NO,(3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O)
(1)参加反应的铜的质量是___ ?
(2)被还原的硝酸的物质的量是___ ?
(1)参加反应的铜的质量是
(2)被还原的硝酸的物质的量是
您最近一年使用:0次
名校
解题方法
7 . 氯气的实验室制法有多种,其中一种可以用重铬酸钾和浓盐酸制取。其变化可表述为:K2Cr2O7+14HCl (浓)=2KCl+2CrCl3+3Cl2 ↑+7H2O。
(1)请标出上述方程式的电子转移方向和数目__________ 。
(2)上述反应中被还原的元素为________ 。
(3)氧化产物与还原产物的物质的量之比为___________ 。
(4)浓盐酸在反应中显示出来的性质是________________ 。
(5)若有14.7g K2Cr2O7 发生上述反应,则转移的电子数为_____ 个, 产生的气体在标准状况下的体积为________ L。
(1)请标出上述方程式的电子转移方向和数目
(2)上述反应中被还原的元素为
(3)氧化产物与还原产物的物质的量之比为
(4)浓盐酸在反应中显示出来的性质是
(5)若有14.7g K2Cr2O7 发生上述反应,则转移的电子数为
您最近一年使用:0次
2020-10-22更新
|
237次组卷
|
2卷引用:新疆伊犁新源县2020-2021学年高一11月月考化学试题
名校
8 . 用双线桥法表示下列反应的电子转移情况 并将其改写成离子方程式 :3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,________________________ ,离子方程式为________________________ 。当3.84gCu被氧化时,__________ gHNO3被还原,产生标准状况下的气体________ L,转移电子数为________ 。
您最近一年使用:0次
2020-10-05更新
|
295次组卷
|
3卷引用:新疆哈密市第十五中学2018-2019学年高一上学期期末考试化学试题
名校
解题方法
9 . 实验室中所用少量氯气是用MnO2和浓盐酸制取的,用浓盐酸200ml,其密度为1.19g·cm-3,HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了11.2L(标况)的氯气。试计算:
①浓盐酸的物质的量浓度?___
②求参加反应的HCl的物质的量?___
③被氧化的HCl的质量?___
①浓盐酸的物质的量浓度?
②求参加反应的HCl的物质的量?
③被氧化的HCl的质量?
您最近一年使用:0次
10 . 已知铜和浓硫酸可以在加热条件下发生如下反应:
Cu+2H2SO4(浓) CuSO4+ SO2 ↑ +2H2O
CuSO4+ SO2 ↑ +2H2O
(1)取一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,计算生成的CuSO4的质量_______ 和生成的SO2气体在标准状况下体积_______ (假设气体全部逸出)。
(2)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,计算:反应后所得沉淀的质量_______ (保留到0.1g)。
Cu+2H2SO4(浓)
 CuSO4+ SO2 ↑ +2H2O
CuSO4+ SO2 ↑ +2H2O(1)取一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,计算生成的CuSO4的质量
(2)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,计算:反应后所得沉淀的质量
您最近一年使用:0次
2019-11-25更新
|
148次组卷
|
2卷引用:新疆喀什地区巴楚县第一中2021届高三上学期第一次模拟考试化学试题



