名校
解题方法
1 . 向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。
(1)Cu和Cu2O的混合物中铜的物质的量为________ mol
(2)产生的NO在标准状况下的体积为______ L
(3)硝酸的物质的量浓度为_____________ mol/L
(4)Cu、Cu2O与硝酸反应后剩余HNO3为______ mol
(1)Cu和Cu2O的混合物中铜的物质的量为
(2)产生的NO在标准状况下的体积为
(3)硝酸的物质的量浓度为
(4)Cu、Cu2O与硝酸反应后剩余HNO3为
您最近一年使用:0次
2020-05-12更新
|
1068次组卷
|
3卷引用:内蒙古赤峰二中2019-2020学年高一下学期第一次月考化学试题
2 . 已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
请回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______ g,产生氢气的体积(标准状况)_________ L。
(2)反应②中_________ 作氧化剂,___________ 是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________ 。
(4)用单线桥法表示反应③电子转移的方向和数目。KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
______________
(5)反应③中盐酸表现_________________ 性。
②Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
请回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是
(2)反应②中
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是
(4)用单线桥法表示反应③电子转移的方向和数目。KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(5)反应③中盐酸表现
您最近一年使用:0次
名校
3 . 将128 g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8 L(标准状况)。
(1)写出上述过程中有关反应的离子方程式:___________________ 、_______________ 。
(2)混合气体中NO2的体积为__________ L,NO的体积________ L(均为标准状况下)。
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为________ mol。
(1)写出上述过程中有关反应的离子方程式:
(2)混合气体中NO2的体积为
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为
您最近一年使用:0次
2019-04-03更新
|
416次组卷
|
3卷引用:【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题
【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题沪科版高中化学拓展课程第5章《非金属元素》检测题(已下线)2019年12月12日 《每日一题》化学人教版(必修1)——硝酸与金属反应的有关计算
名校
解题方法
4 . (1)如下图实验装置,当有16.8g铁粉参加反应时,生成的气体在标准状况下的体积是__________ L。
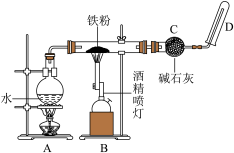
(2)向Cu和CuO组成的混合物中,加入100mL 6.0mol·L1稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:
①原混合物中Cu和CuO的物质的量之比为____________ ;
②假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为______ mol·L1;
③若将生成的NO气体完全溶解,需要标准状况下的氧气的物质的量为______ 。

(2)向Cu和CuO组成的混合物中,加入100mL 6.0mol·L1稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:
①原混合物中Cu和CuO的物质的量之比为
②假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为
③若将生成的NO气体完全溶解,需要标准状况下的氧气的物质的量为
您最近一年使用:0次
名校
5 . 在一定条件下, 和I-可以发生反应,离子方程式为
和I-可以发生反应,离子方程式为 +6I-+6H+===R-+3I2+3H2O。
+6I-+6H+===R-+3I2+3H2O。
根据计算回答:
(1) 中n值为
中n值为________ ;
(2)每有0.2mol 参加反应,转移的电子数目为
参加反应,转移的电子数目为________ 。
 和I-可以发生反应,离子方程式为
和I-可以发生反应,离子方程式为 +6I-+6H+===R-+3I2+3H2O。
+6I-+6H+===R-+3I2+3H2O。根据计算回答:
(1)
 中n值为
中n值为(2)每有0.2mol
 参加反应,转移的电子数目为
参加反应,转移的电子数目为
您最近一年使用:0次
名校
解题方法
6 . 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。
(1)NO的体积为_______ ;
(2)NO2的体积为______ 。
(1)NO的体积为
(2)NO2的体积为
您最近一年使用:0次
2016-12-09更新
|
334次组卷
|
4卷引用:2015-2016学年内蒙古巴彦淖尔一中高一上期末化学试卷1
2015-2016学年内蒙古巴彦淖尔一中高一上期末化学试卷12015-2016学年宁夏中卫一中高一下第一次月考化学试卷(已下线)【走进新高考】(人教版必修一)4.4.2氨、硝酸、硫酸——硝酸 同步练习02甘肃省天水市第一中学2020-2021学年高一下学期第一阶段考试化学(文)试题
解题方法
7 . 用17.4g二氧化锰和足量的浓盐酸充分反应后,列式计算被氧化的HCl的质量是多少?
您最近一年使用:0次
名校
8 . 在酸性溶液中用400mL 0.075mol·L-1的KMnO4溶液处理2g Cu2S和CuS的混合物,发生如下反应:8MnO4-+5Cu2S +44H+=10Cu2++5SO2+8Mn2++22H2O; 6MnO4-+5CuS +28H+=5Cu2++5SO2+6Mn2++14H2O反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol·L-1的FeSO4溶液完全反应。请完成以下问题:
(1)配平KMnO4与FeSO4反应的离子方程式:__________ MnO4-+_______ Fe2++__________ H+=__________ Mn2++__________ Fe3++__________ H2O
(2)KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为__________ mol
(3)混合物中Cu2S的质量分数为__________
(1)配平KMnO4与FeSO4反应的离子方程式:
(2)KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为
(3)混合物中Cu2S的质量分数为
您最近一年使用:0次
2016-11-02更新
|
542次组卷
|
2卷引用:【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一上学期第二次月考化学试题
11-12高一上·内蒙古包头·期末
9 . 实验室可用如下反应制取氯气,反应原理如下: 2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)用单线桥表示出上述反应中电子转移的方向和数目_________
(2)上述反应中氧化剂与还原剂的物质的量比_________
(3)15.8g KMnO4能使_________ 克HCl被氧化?
(4)产生的Cl2在标准状况下的体积为_________ ?
(1)用单线桥表示出上述反应中电子转移的方向和数目
(2)上述反应中氧化剂与还原剂的物质的量比
(3)15.8g KMnO4能使
(4)产生的Cl2在标准状况下的体积为
您最近一年使用:0次



