1 . K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于_______ (填“酸”、“碱”或“盐”)。
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了_______ mole-,该高铁酸钾样品的纯度为_______ 。(用质量分数表示)
③高铁酸钾可用于消毒的原因是_______ 。
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是_______ 。
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是_______ ;
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了
③高铁酸钾可用于消毒的原因是
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和NaHCO3溶液 |
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是
您最近一年使用:0次
2 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
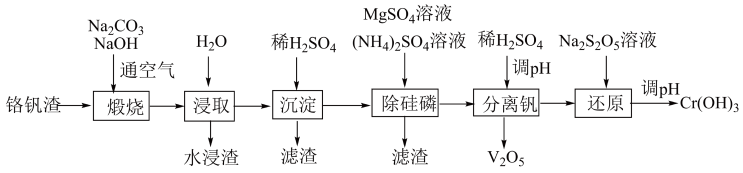
已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ (写化学式)。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ (写化学式)。
(4)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,还原Cr2O ,写出该反应的离子方程式为
,写出该反应的离子方程式为___________ 。
(5)已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于6.4×10-7mol·L-1,此时溶液中的c(H+)<______ mol·L-1。
(6)已知:Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示
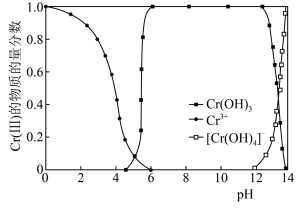
请补充完整由 溶液制得
溶液制得 的实验方案:取分离、提纯得到的
的实验方案:取分离、提纯得到的 溶液,
溶液,___________ ,低温烘干,得到高纯 晶体。[实验中
晶体。[实验中须使用 的试剂:2mol/LNaOH溶液、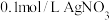 溶液、
溶液、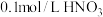 溶液、蒸馏水]
溶液、蒸馏水]

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,还原Cr2O
 ,写出该反应的离子方程式为
,写出该反应的离子方程式为(5)已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于6.4×10-7mol·L-1,此时溶液中的c(H+)<
(6)已知:Cr(Ⅲ)的存在形态的物质的量分数随溶液pH的分布如图所示

请补充完整由
 溶液制得
溶液制得 的实验方案:取分离、提纯得到的
的实验方案:取分离、提纯得到的 溶液,
溶液, 晶体。[实验中
晶体。[实验中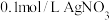 溶液、
溶液、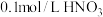 溶液、蒸馏水]
溶液、蒸馏水]
您最近一年使用:0次
名校
解题方法
3 . 硫氰化钾(KSCN)是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰化钾。

已知:①CS2为不溶于水且密度比水大的非极性试剂。
②NH4HS、(NH4)2S 在热水中易分解生成NH3和H2S。
③装置B中,滴液漏斗中装有一定体积5mol/L KOH溶液。
回答下列问题:
(1)制备NH4SCN溶液:
①三颈烧瓶内盛放有76g CS2、水和难溶于水的固体做催化剂。实验开始时,打开K1,水浴加热装置B,发生反应CS2+ 3NH3 NH4SCN + NH4HS, 则装置A中固体a的成分为
NH4SCN + NH4HS, 则装置A中固体a的成分为 _______ 。
②一段时间后,当观察到三颈烧瓶内_______ 时, 停止通入气体,反应完成。关闭K1和K2,将三颈烧瓶继续加热一段时间。
③装置C中用酸性KMnO4溶液吸收尾气后得澄清溶液,H2S所发生反应的离子方程式为_______ 。
(2)制备KSCN晶体:
打开K3,_______ , 干燥,得到硫氰化钾晶体。(须用的试剂:5mol/LKOH、蒸馏水、稀硫酸)
(3)测定产品中KSCN的含量:
称取0.85g样品,配成100mL溶液。量取25.00mL溶液锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,滴定时发生的反应:SCN—+Ag+=AgSCN↓(白色)。达到滴定终点,三次滴定平均消耗AgNO3标准溶液20.00mL。产品中KSCN的质量分数为_______ 。

已知:①CS2为不溶于水且密度比水大的非极性试剂。
②NH4HS、(NH4)2S 在热水中易分解生成NH3和H2S。
③装置B中,滴液漏斗中装有一定体积5mol/L KOH溶液。
回答下列问题:
(1)制备NH4SCN溶液:
①三颈烧瓶内盛放有76g CS2、水和难溶于水的固体做催化剂。实验开始时,打开K1,水浴加热装置B,发生反应CS2+ 3NH3
 NH4SCN + NH4HS, 则装置A中固体a的成分为
NH4SCN + NH4HS, 则装置A中固体a的成分为 ②一段时间后,当观察到三颈烧瓶内
③装置C中用酸性KMnO4溶液吸收尾气后得澄清溶液,H2S所发生反应的离子方程式为
(2)制备KSCN晶体:
打开K3,
(3)测定产品中KSCN的含量:
称取0.85g样品,配成100mL溶液。量取25.00mL溶液锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,滴定时发生的反应:SCN—+Ag+=AgSCN↓(白色)。达到滴定终点,三次滴定平均消耗AgNO3标准溶液20.00mL。产品中KSCN的质量分数为
您最近一年使用:0次
2022-04-20更新
|
459次组卷
|
4卷引用:江苏省南通市海门区2022届高三下学期阶段检测化学试题
江苏省南通市海门区2022届高三下学期阶段检测化学试题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)江西省重点校联盟2022-2023学年高三上学期10月联考化学试题新疆乌鲁木齐市第101中学2023-2024学年高三上学期8月月考化学试题
名校
解题方法
4 . 钴是元素周期表第四周期第Ⅷ族元素,其化合物用途广泛。如: 作锂电池的正极材料。
作锂电池的正极材料。
I.(1)基态Co原子的价层电子排布式为_______ 。
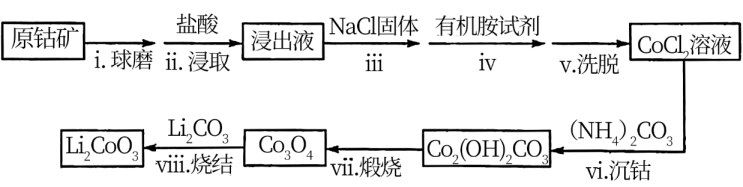
II.利用原钴矿 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
资料:①在含一定量 的溶液中:
的溶液中: 。
。
② 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。
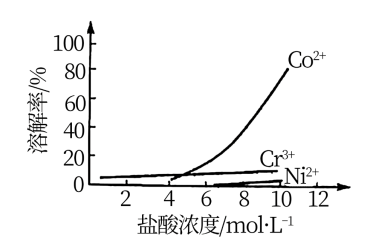
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
(2)步骤i的目的是_______ 。
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:_______ 。
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是_______ 。
(5)步骤vi用 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
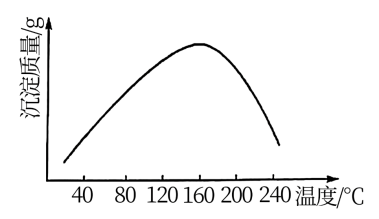
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因___ 。
(6)步骤vi沉钴中(常温下进行),若滤液中 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为___ 。
(7)步骤viii中 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是_______ 。
 作锂电池的正极材料。
作锂电池的正极材料。I.(1)基态Co原子的价层电子排布式为
II.利用原钴矿
 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
资料:①在含一定量
 的溶液中:
的溶液中: 。
。②
 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:

(2)步骤i的目的是
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是
(5)步骤vi用
 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
(6)步骤vi沉钴中(常温下进行),若滤液中
 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为
(7)步骤viii中
 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是
您最近一年使用:0次
2021-03-04更新
|
253次组卷
|
2卷引用:江苏省南京市中华中学 2021-2022学年高三上学期第一次月考化学试题
名校
解题方法
5 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
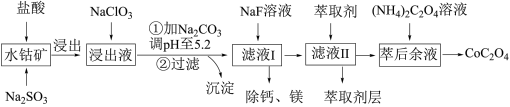
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
5卷引用:江苏省扬州中学2017届高三下学期期中考试化学试题



