1 . 双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。某学习小组设计一组与双氧水相关的实验如表所示:
请回答下列问题:
(1)实验Ⅰ的离子方程式为_____________________________ ;该原理广泛用于除去Fe3+中的Fe2+的操作中,此操作的优点是__________ 。
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是________ ,反应的离子方程式为_________________________ 。当有1.7g过氧化氢参加反应时转移的电子数目为_____________ 。
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是________ (填选项字母)。
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式________________________________________ 。
| 实验 | 实验操作与现象 |
| Ⅰ | 向含少量硫酸亚铁的硫酸铁溶液中滴加双氧水和稀硫酸 |
| Ⅱ | 向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去 |
| Ⅲ | 向淀粉-KI溶液中滴加双氧水,溶液变蓝色 |
| Ⅳ | 向双氧水加入铁红粉末,产生大量气泡 |
请回答下列问题:
(1)实验Ⅰ的离子方程式为
(2)实验Ⅱ可用于测定双氧水的浓度,用酸性高锰酸钾溶液滴定双氧水,达到滴定终点的标志是
(3)在实验Ⅲ和Ⅳ中双氧水没有表现的性质是
A.氧化性 B.还原性 C.不稳定性 D.酸性
(4)双氧水能将碱性废水中的CN-转化成碳酸盐和一种使湿润的红色石蕊试纸变蓝的气体,写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的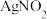 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______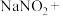 _______
_______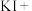 _______
_______ _______
_______ _______
_______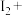 _______
_______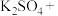 _______
_______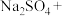 _______
_______
(1)请完成该化学方程式并配平。_______
(2) 中N的化合价为
中N的化合价为_______ ,由N的化合价推测 具有
具有_______ (填“氧化性”、“还原性”或“氧化性、还原性”)。
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是_______ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的_______ (填“氧化性”或“还原性”)应该比 更
更_______ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和
和 的是_______(填序号)。
的是_______(填序号)。
(5) 与
与 反应:
反应: ,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是
,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是_______ mol。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式_______ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的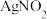 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: _______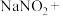 _______
_______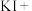 _______
_______ _______
_______ _______
_______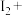 _______
_______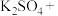 _______
_______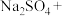 _______
_______
(1)请完成该化学方程式并配平。
(2)
 中N的化合价为
中N的化合价为 具有
具有(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的 更
更(4)下列方法不能用来区分固体
 和
和 的是_______(填序号)。
的是_______(填序号)。| A.分别溶于水并滴加酚酞试液 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 与
与 反应:
反应: ,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是
,若有0.5mol氧化剂被还原,则被氧化的还原剂的物质的量是(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式
您最近一年使用:0次
名校
3 . 高铁酸钾( ,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
实验(一)制备
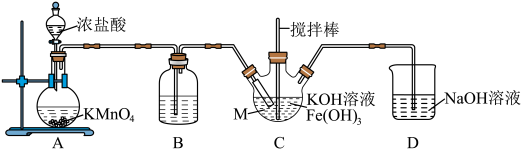
(1)仪器M的名称是_______ ,装置B的作用是_______ 。
(2)装置C中生成 的化学方程式为
的化学方程式为______ 。
(3)实验得知装置C中吸收 的量为装置A中生成
的量为装置A中生成 总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成
总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成 的质量为
的质量为_______ g。
实验(二)探究 的性质。
的性质。
Ⅰ.探究 在酸性条件下的稳定性。
在酸性条件下的稳定性。
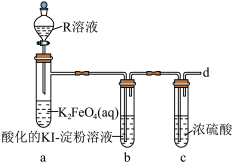
已知:实验中观察到试管b中溶液变为蓝色,试管a中溶液由紫红色变黄色并产生气泡。
(4)R溶液为_______ (填“稀硫酸”或“盐酸”),写出装置a中的离子方程式:______ ,不选择另一种酸的主要原因是_______ 。
(5)设计一种方案检验从d中逸出的气体:_______
Ⅱ.探究在酸性条件下的氧化性。
(6)向 溶液中滴加少量用稀硫酸酸化后的
溶液中滴加少量用稀硫酸酸化后的 溶液,溶液呈紫红色。
溶液,溶液呈紫红色。_______ (填“能”或“不能”)证明氧化性: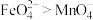 ,原因是
,原因是_______ (用文字说明)。
 ,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:实验(一)制备


(1)仪器M的名称是
(2)装置C中生成
 的化学方程式为
的化学方程式为(3)实验得知装置C中吸收
 的量为装置A中生成
的量为装置A中生成 总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成
总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成 的质量为
的质量为实验(二)探究
 的性质。
的性质。Ⅰ.探究
 在酸性条件下的稳定性。
在酸性条件下的稳定性。
已知:实验中观察到试管b中溶液变为蓝色,试管a中溶液由紫红色变黄色并产生气泡。
(4)R溶液为
(5)设计一种方案检验从d中逸出的气体:
Ⅱ.探究在酸性条件下的氧化性。
(6)向
 溶液中滴加少量用稀硫酸酸化后的
溶液中滴加少量用稀硫酸酸化后的 溶液,溶液呈紫红色。
溶液,溶液呈紫红色。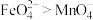 ,原因是
,原因是
您最近一年使用:0次
2023-09-27更新
|
354次组卷
|
11卷引用:青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷
青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷河北省邢台市五岳联盟2023-2024学年高三上学期9月月考化学试题河北省部分学校2023-2024学年高三上学期9月月考化学试题河南省2023-2024学年高三上学期一轮复习阶段性检测(三)化学试题河南省驻马店市第一次联考2023-2024学年高三上学期9月月考化学试题江西省部分高中学校2024届高三上学期9月大联考化学试题福建省2023-2024学年高三上学期10月百万大联考化学试题 河南省洛阳市洛宁县第一高级中学2023-2024学年高三上学期阶段性考试(三)化学试题河北省保定部分高中2023-2024学年高三上学期9月月考化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省濮阳市油田第一中学2024届高三上学期第一次考试理科综合化学试题
名校
解题方法
4 . 常用于印染工业的连二亚硫酸钠(Na2S2O4)俗称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:
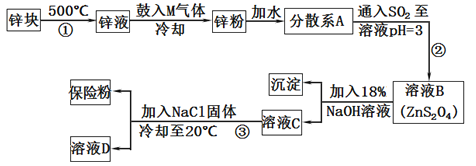
请回答下列问题:
(1)保险粉应如何保存?_______________________ (填一个注意事项)。
(2)由锌块制备锌粉的目的是___________ ;向液锌中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm(1m=106μm)的锌粉.鼓入气体M为常见的双原子单质分子,则M的化学式为___________ ;分散系A为____________ (填“溶液”“胶体”或“悬浊液”)。
(3)流程②的化学方程式为_____________________ 。
(4)流程③的分离方法步骤为___________ 、洗涤、干燥,其中洗涤所用试剂是__________ ;实验室加入NaCl固体的作用是_____________ 。
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式____________________ 。
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②__________________ 。

请回答下列问题:
(1)保险粉应如何保存?
(2)由锌块制备锌粉的目的是
(3)流程②的化学方程式为
(4)流程③的分离方法步骤为
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②
您最近一年使用:0次
2017-02-17更新
|
1264次组卷
|
2卷引用:青海湟川中学2020-2021学年高一下学期3月考化学试题



