名校
解题方法
1 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
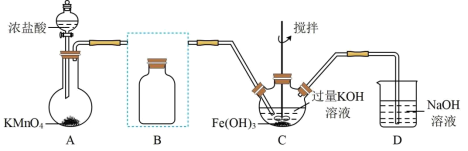
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 高铁酸钾是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
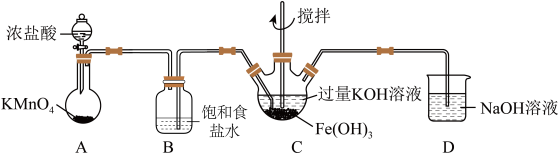
①如图所示,A为氯气发生装置。装置A、B、C、D中存在错误的是______________ (填序号)。
②C中得到紫色固体和溶液。C中通入氯气发生反应,生成高铁酸钾(K2FeO4)的化学方程式为_______ ,此外Cl2还可能与过量的KOH反应。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4,氧化了Cl-而产生Cl2,设计以下方案:
i.由方案I中溶液变红可知溶液a中含有__________ 离子,但该离子的存在不能判断一定是K2FeO4,氧化了Cl2,因为K2FeO4,在酸性溶液中不稳定,请写出K2FeO4在酸性溶液中发生反应的离子方程式___________________________________ 。
ii.方案Ⅱ可证明K2FeO4,氧化了Cl-.用KOH溶液洗涤的目的是_______________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2_____ FeO42- (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系恰好相反,原因是_______________ 。
(3)若在制备装置C中加入Fe(OH)3的质量为14.0g,充分反应后经过滤、洗涤、干燥得K2FeO4固体19.3g,则K2FeO4的产率为______________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①如图所示,A为氯气发生装置。装置A、B、C、D中存在错误的是
②C中得到紫色固体和溶液。C中通入氯气发生反应,生成高铁酸钾(K2FeO4)的化学方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4,氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案I中溶液变红可知溶液a中含有
ii.方案Ⅱ可证明K2FeO4,氧化了Cl-.用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
(3)若在制备装置C中加入Fe(OH)3的质量为14.0g,充分反应后经过滤、洗涤、干燥得K2FeO4固体19.3g,则K2FeO4的产率为
您最近一年使用:0次
2020-05-30更新
|
727次组卷
|
8卷引用:山东省济南市商河县第一中学2021届高三上学期阶段性考试化学试题
山东省济南市商河县第一中学2021届高三上学期阶段性考试化学试题福建省连城县第一中学2021届高三上学期第一次月考化学试题河南省六市(南阳市、驻马店市、信阳市、漯河市、周口市、三门峡市)2020届高三第二次联合调研检测理综化学试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)易错23 化学实验评价与探究-备战2021年高考化学一轮复习易错题四川省重点高中2021届高三下学期入学考试化学试题福建省莆田二中2021-2022学年高三上学期期中考试化学试题
3 . 研究氮及其化合物的制备性质具有重要的意义。回答下列问题:
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证 的性质。
的性质。________ ,锥形瓶中的药品是________ 。
(2)装置乙的作用是________ ;装置丙用于收集 ,应将导管
,应将导管________ (填“a”或“b”)延长至集气瓶底部。
(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为__________ ,证明氨气具有________ (填“氧化性”或“还原性”)。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是________ (填标号)。 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为_____________ 。
(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是________________ 。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证
 的性质。
的性质。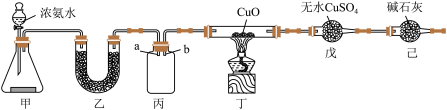
(2)装置乙的作用是
 ,应将导管
,应将导管(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是
a.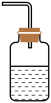 b.
b. c.
c. d.
d.
 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。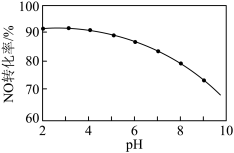
 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是
您最近一年使用:0次
2023-04-27更新
|
180次组卷
|
3卷引用:山东省临沂市沂水县第四中学2023-2024学年高一下学期阶段性质量检测 化学试卷
解题方法
4 . 亚硝酸钠是一种具有咸味、有毒的工业用盐,工业上常用作防腐剂。
(1)NaNO2中N的化合价为_______ ,由N的化合价推测NaNO2具有_______ (填“氧化性”、“还原性”或“氧化性、还原性”)。
(2)NaNO2易溶于水,水溶液显碱性。写出HNO2的电离方程式_______ 。
(3)酸性条件下, 能与
能与 反应得到
反应得到 ,写出此反应的离子方程式
,写出此反应的离子方程式_______ 。
(4)NaNO2与HI反应:2NaNO2+4HI =2NO↑+I2+2NaI+2H2O,若有0.5 mol氧化剂被还原,则被氧化的还原剂的物质的量是_______ mol。
(5)工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式_______ ,理论上53.5 kg NH4Cl可除去废水中的
_______ mol。
(1)NaNO2中N的化合价为
(2)NaNO2易溶于水,水溶液显碱性。写出HNO2的电离方程式
(3)酸性条件下,
 能与
能与 反应得到
反应得到 ,写出此反应的离子方程式
,写出此反应的离子方程式(4)NaNO2与HI反应:2NaNO2+4HI =2NO↑+I2+2NaI+2H2O,若有0.5 mol氧化剂被还原,则被氧化的还原剂的物质的量是
(5)工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式

您最近一年使用:0次
2020-12-30更新
|
96次组卷
|
2卷引用:山东省滨州市沾化区实验高级中学2022-2023学年高三上学期第二次月考化学试题
5 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中的化学反应方程式是________________ (锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有__________________ (写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否为K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由____________________________________ 产生(用离子方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________ FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中的化学反应方程式是
②C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否为K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
您最近一年使用:0次
6 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
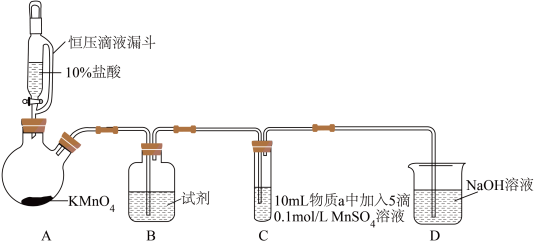
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
760次组卷
|
29卷引用:山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)微专题 物质性质综合实验探究北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题
名校
7 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
名校
8 . I.海带中含有丰富的碘,某学习小组设计并进行以下实验:
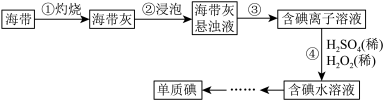
(1)步骤③的实验操作所用。用到的玻璃仪器有___________ 。步骤④的离子反应方程式为: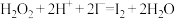 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是___________ ,还原剂是___________ 。步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现蓝色,说明有碘单质产生。
II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失, 被氧气氧化成碘单质(I2),同时得到强碱性物质。
被氧气氧化成碘单质(I2),同时得到强碱性物质。
(2)写出潮湿环境下KI与氧气反应的化学方程式:___________ 。
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:
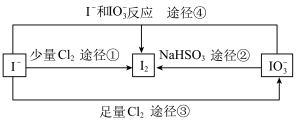
(3)四个途径中属于氧化还原反应的是___________ (填序号)。
(4)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为: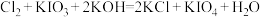 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(5)比较I2、 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:___________ 。

(1)步骤③的实验操作所用。用到的玻璃仪器有
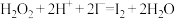 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,
 被氧气氧化成碘单质(I2),同时得到强碱性物质。
被氧气氧化成碘单质(I2),同时得到强碱性物质。(2)写出潮湿环境下KI与氧气反应的化学方程式:
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:

(3)四个途径中属于氧化还原反应的是
(4)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为:
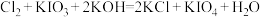 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)比较I2、
 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:
您最近一年使用:0次
名校
9 . Ⅰ.海带中含有丰富的碘,某学习小组设计并进行以下实验:
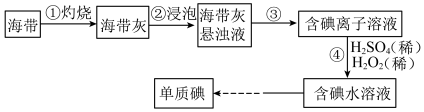
(1)步骤③的实验操作为___________ (填实验名称),此过程使用玻璃棒,玻璃棒的作用是___________ 。
(2)步骤④的离子反应方程式为: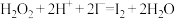 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是___________ ,还原剂是___________ 。步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现蓝色,说明有碘单质产生。
Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失, 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。
(3)写出潮湿环境下 与氧气反应的化学方程式:
与氧气反应的化学方程式:___________ 。
Ⅲ.现在的食盐里改添加性质稳定的 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
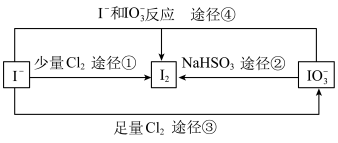
(4)四个途径中属于氧化还原反应的是___________ (填序号)。
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(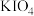 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(6)比较 、
、 和
和 的氧化性强弱:
的氧化性强弱:___________ 。

(1)步骤③的实验操作为
(2)步骤④的离子反应方程式为:
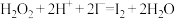 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,
 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。(3)写出潮湿环境下
 与氧气反应的化学方程式:
与氧气反应的化学方程式:Ⅲ.现在的食盐里改添加性质稳定的
 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
(4)四个途径中属于氧化还原反应的是
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(
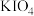 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:(6)比较
 、
、 和
和 的氧化性强弱:
的氧化性强弱:
您最近一年使用:0次
名校
解题方法
10 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_________ (填序号)。
甲. 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_________ ;②加入_________ 。
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_________ 。
(4)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 作用,得到
作用,得到 最多的是
最多的是___________ 。
(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为 ),可用如图转化方式除去。
),可用如图转化方式除去。
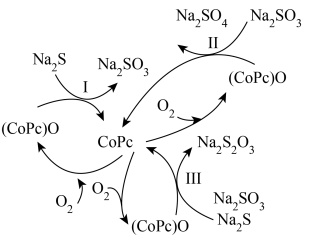
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为___________ 。
②在废水处理整个过程中,催化剂为___________ ,氧化剂为___________ 。
③反应Ⅲ中 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式_________________ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值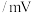 | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
甲.
 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于
 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为
 ),可用如图转化方式除去。
),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为
②在废水处理整个过程中,催化剂为
③反应Ⅲ中
 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式
您最近一年使用:0次
2023-12-04更新
|
386次组卷
|
2卷引用:山东省青岛平度市第一中学2023-2024学年高一上学期迎元旦月考化学试题



