2021·福建泉州·模拟预测
解题方法
1 . 某化学兴趣小组设计如下实验探究硫代硫酸钠( )的化学性质。
)的化学性质。
资料:① 溶液在酸性条件下分解:
溶液在酸性条件下分解:
②
回答下列问题:
I.实验一 溶液的酸碱性
溶液的酸碱性
(1)可用_______ 试纸测定 该溶液的酸碱性。
该溶液的酸碱性。
II.实验二 溶液的还原性
溶液的还原性
取溴水于试管中,滴加 溶液至溴水褪色。
溶液至溴水褪色。
(2)该反应的离子方程式为_______ 。
III.实验三 探究 的热分解产物
的热分解产物
设计如图所示装置进行实验,实验过程中观察到试管内固体熔化、沸腾。反应后,试管中观察到白色物质夹杂着较多淡黄色固体。
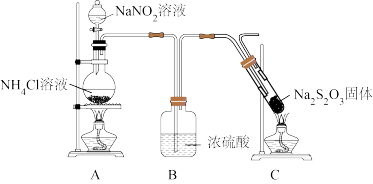
(3)实验开始时,应先点燃_______ 处的酒精灯,目的是_______ 。
(4)兴趣小组对分解产物的组成提出四种观点:
甲观点: 、S乙观点:
、S乙观点: 、
、 、S
、S
丙观点: 、S丁观点:
、S丁观点: 、
、 、S
、S
①为了证明丙观点是错误的,需检验产物中有 ,实验方案是
,实验方案是_______ 。
②取少量固体加入稀硫酸,将生成的气体通入品红溶液,观察到品红溶液褪色。该实验不能证明产物中一定有 ,理由是
,理由是_______ 。
③甲和乙观点是错误的,说明理由_______ (任选一种观点回答)。
④经实验证实,丁观点是正确的。写出分解反应的化学方程式:_______ 。
 )的化学性质。
)的化学性质。资料:①
 溶液在酸性条件下分解:
溶液在酸性条件下分解:
②

回答下列问题:
I.实验一
 溶液的酸碱性
溶液的酸碱性(1)可用
 该溶液的酸碱性。
该溶液的酸碱性。II.实验二
 溶液的还原性
溶液的还原性取溴水于试管中,滴加
 溶液至溴水褪色。
溶液至溴水褪色。(2)该反应的离子方程式为
III.实验三 探究
 的热分解产物
的热分解产物设计如图所示装置进行实验,实验过程中观察到试管内固体熔化、沸腾。反应后,试管中观察到白色物质夹杂着较多淡黄色固体。

(3)实验开始时,应先点燃
(4)兴趣小组对分解产物的组成提出四种观点:
甲观点:
 、S乙观点:
、S乙观点: 、
、 、S
、S丙观点:
 、S丁观点:
、S丁观点: 、
、 、S
、S①为了证明丙观点是错误的,需检验产物中有
 ,实验方案是
,实验方案是②取少量固体加入稀硫酸,将生成的气体通入品红溶液,观察到品红溶液褪色。该实验不能证明产物中一定有
 ,理由是
,理由是③甲和乙观点是错误的,说明理由
④经实验证实,丁观点是正确的。写出分解反应的化学方程式:
您最近一年使用:0次
22-23高三上·广东·阶段练习
名校
2 . 三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的装置如图所示:
的装置如图所示:
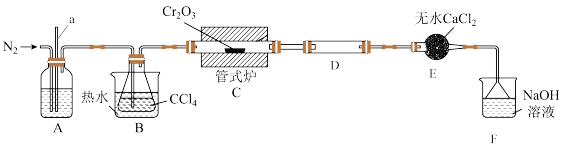
已知:碱性条件下, 可将
可将 氧化
氧化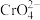 (黄色);酸性条件下,
(黄色);酸性条件下, 可将
可将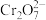 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
回答下列问题:
(1)基态Cr原子的核外电子排布式为_______ 。
(2)装置B中热水的作用是_______ ;实验进行一段时间后,发现导管a中的液面在不断上升,出现该现象的可能原因是_______ ,改进的措施是_______ 。
(3)对于装置C中发生的反应,甲、乙分别提出了两种不同的观点,甲认为发生的反应是 ;乙认为发生的反应是
;乙认为发生的反应是 。
。
Ⅰ.查阅资料知: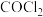 (俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为
(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为_______ 。
Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中,_______ ,证明甲的观点正确,
(4)测定某样品中 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:
Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30% 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为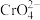 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使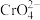 转化为
转化为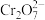 ,再加适量的蒸馏水将溶液稀释至100mL
,再加适量的蒸馏水将溶液稀释至100mL
Ⅲ.取25.00mL溶液,加入适量浓 混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的
混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液21.00mL(滴定中
标准溶液21.00mL(滴定中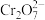 被
被 还原为
还原为 )。
)。
①步骤Ⅰ中完全转化时发生反应的离子方程式为_______ 。
②该样品中 的质量分数为
的质量分数为_______ 。
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的装置如图所示:
的装置如图所示:
已知:碱性条件下,
 可将
可将 氧化
氧化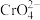 (黄色);酸性条件下,
(黄色);酸性条件下, 可将
可将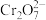 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。回答下列问题:
(1)基态Cr原子的核外电子排布式为
(2)装置B中热水的作用是
(3)对于装置C中发生的反应,甲、乙分别提出了两种不同的观点,甲认为发生的反应是
 ;乙认为发生的反应是
;乙认为发生的反应是 。
。Ⅰ.查阅资料知:
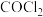 (俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为
(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中,
(4)测定某样品中
 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30%
 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为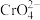 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使
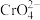 转化为
转化为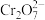 ,再加适量的蒸馏水将溶液稀释至100mL
,再加适量的蒸馏水将溶液稀释至100mLⅢ.取25.00mL溶液,加入适量浓
 混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的
混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液21.00mL(滴定中
标准溶液21.00mL(滴定中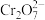 被
被 还原为
还原为 )。
)。①步骤Ⅰ中完全转化时发生反应的离子方程式为
②该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2022-10-12更新
|
486次组卷
|
5卷引用:山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(实验综合题)
(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(实验综合题)广东省部分学校2022-2023学年高三上学期10月联考化学试题江西省赣州市五校联考2022-2023学年高三上学期期中考试化学试题湖南省邵东市第一中学2022-2023学年高二上学期期中考试化学试题安徽省滁州市实验中学等2校2022-2023学年高二上学期1月期末考试化学试题
2021·江苏·三模
名校
3 . 高铁酸钾(K2FeO4)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓KOH溶液,且能与水反应放出氧气,并生成Fe(OH)3胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4等。工业上湿法制备K2FeO4的流程如下:

下列关于K2FeO4的工业湿法制备工艺,说法正确的是

下列关于K2FeO4的工业湿法制备工艺,说法正确的是
| A.“反应”时,氧化剂和还原剂的物质的量之比为2:3 |
B.“过滤I”所得滤液中大量存在的离子有:Na+、Fe3+、Cl-、NO 、FeO 、FeO |
| C.“转化”时,反应能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小 |
| D.“过滤II”所得滤液在酒精灯外焰上灼烧,观察到火焰呈黄色,说明滤液为NaOH溶液 |
您最近一年使用:0次
2021-05-08更新
|
1232次组卷
|
11卷引用:山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(选择题6-10)
(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(选择题6-10)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题14 氢氧化亚铁、高铁酸盐的制备实验探究-备战2023年高考化学一轮复习考点微专题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省七市(南通、扬州、泰州、淮安、徐州、宿迁、连云港)2021届高三第三次调研考试化学试题江苏省苏州市木渎高级中学、苏州实验中学、苏州新区一中2020-2021学年高一下学期联合调研化学试题江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题
2021·江苏·三模
名校
解题方法
4 . 高铁酸钾(K2FeO4)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓KOH溶液,且能与水反应放出氧气,并生成Fe(OH)3胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4等。工业上湿法制备K2FeO4的流程如下:

下列关于K2FeO4的说法正确的是

下列关于K2FeO4的说法正确的是
| A.与水反应,每消耗1molK2FeO4转移6mol电子 |
| B.将K2FeO4与盐酸混合使用,可增强其杀菌消毒效果 |
| C.可用丁达尔效应鉴别K2FeO4和KMnO4两种紫红色溶液 |
| D.K2FeO4中,基态K+的核外三个电子能层均充满电子 |
您最近一年使用:0次
2021-05-08更新
|
736次组卷
|
7卷引用:山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(选择题6-10)
2021·山东滨州·一模
解题方法
5 . 焦亚硫酸钠 为白色或黄色结晶粉末,遇强酸放出
为白色或黄色结晶粉末,遇强酸放出 .在医药、橡胶、印染、食品、含铬污水处理等方面应用广泛。
.在医药、橡胶、印染、食品、含铬污水处理等方面应用广泛。
(1)利用烟道气中的 生产
生产 的工艺流程如图:
的工艺流程如图:
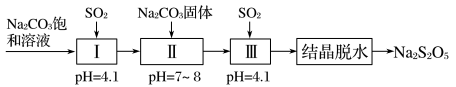
资料:当 溶液过饱和后静置,会结晶析出焦亚硫酸钠晶体。
溶液过饱和后静置,会结晶析出焦亚硫酸钠晶体。
①焦亚硫酸钠中硫元素的化合价为_______ ,常温下焦亚硫酸钠溶于水形成的溶液显_______ 性(填“酸”、“中”或“碱”)。
②控制Ⅰ中反应结束的方法是测定溶液的pH,当 时停止通入
时停止通入 ,此时溶液的溶质主要是
,此时溶液的溶质主要是_______ (填物质名称)。
③Ⅲ中发生反应的化学方程式有_______ 。
(2)研究表明,焦亚硫酸钠处理含铬(VI)废水较其他方法效果好,处理费用低。其工艺流程如图:
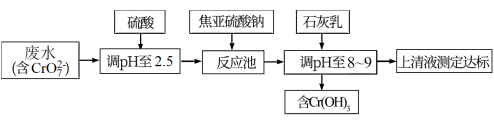
①加硫酸调废水pH至2.5,可增强 的氧化性,但实际工业中若pH过低,则消耗焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因
的氧化性,但实际工业中若pH过低,则消耗焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因_______ 。
②石灰乳的作用为_______ 。
 为白色或黄色结晶粉末,遇强酸放出
为白色或黄色结晶粉末,遇强酸放出 .在医药、橡胶、印染、食品、含铬污水处理等方面应用广泛。
.在医药、橡胶、印染、食品、含铬污水处理等方面应用广泛。(1)利用烟道气中的
 生产
生产 的工艺流程如图:
的工艺流程如图:
资料:当
 溶液过饱和后静置,会结晶析出焦亚硫酸钠晶体。
溶液过饱和后静置,会结晶析出焦亚硫酸钠晶体。①焦亚硫酸钠中硫元素的化合价为
②控制Ⅰ中反应结束的方法是测定溶液的pH,当
 时停止通入
时停止通入 ,此时溶液的溶质主要是
,此时溶液的溶质主要是③Ⅲ中发生反应的化学方程式有
(2)研究表明,焦亚硫酸钠处理含铬(VI)废水较其他方法效果好,处理费用低。其工艺流程如图:

①加硫酸调废水pH至2.5,可增强
 的氧化性,但实际工业中若pH过低,则消耗焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因
的氧化性,但实际工业中若pH过低,则消耗焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因②石灰乳的作用为
您最近一年使用:0次
20-21高三上·江西·阶段练习
6 . 洋葱所含的微量元素硒(34Se)是一种很强的抗氧化剂,能消除体内的自由基,增强细胞的活力和代谢能力,具有防癌抗衰老的功效。工业上用精炼铜的阳极泥(硒主要以CuSe存在,含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体,其工艺流程如图,下列有关说法错误的是


| A.实验室中过滤用到的玻璃仪器为:玻璃棒、烧杯、普通漏斗 |
| B.SeO2既有氧化性又有还原性,其还原性比SO2强 |
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓) CuSO4+SeO2↑+3SO2↑+4H2O CuSO4+SeO2↑+3SO2↑+4H2O |
| D.生产过程中产生的尾气SeO2可以用NaOH溶液吸收 |
您最近一年使用:0次
2020-12-08更新
|
693次组卷
|
8卷引用:押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西名校2021届高三第二次联考化学试题北京市昌平区新学道临川学校2021届高三12月月考化学试题湖南省长郡十五校2021届高三下学期第二次联考化学试题福建省德化一中、永安一中、漳平一中三校协作2022-2023学年高三上学期12月联考化学试题
2021·山东潍坊·二模
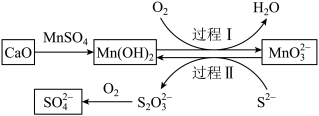
7 . 工业生产中除去电石渣浆(含 )中的
)中的 并制取硫酸盐的一种常用流程如图。下列说法正确的是
并制取硫酸盐的一种常用流程如图。下列说法正确的是
 )中的
)中的 并制取硫酸盐的一种常用流程如图。下列说法正确的是
并制取硫酸盐的一种常用流程如图。下列说法正确的是
A.碱性条件下,氧化性: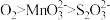 |
B.过程I中氧化剂和还原剂物质的量之比为 |
C.过程Ⅱ中,反应的离子方程式为 |
D.将 转化为 转化为 理论上需要 理论上需要 的体积为 的体积为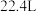 (标准状况) (标准状况) |
您最近一年使用:0次
2021-04-30更新
|
605次组卷
|
5卷引用:专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】
(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省潍坊市2021届高三4月第二次模拟考试化学试题(已下线)山东省滕州市第一中学2023-2024学年高三上学期9月份化学质量检测试题湖南省汉寿县第二中学2022-2023学年高三上学期第二次月考化学试题湖南省株洲市第一中学2022-2023学年高一上学期第三次月考化学试题
16-17高三上·内蒙古巴彦淖尔·阶段练习
名校
解题方法
8 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________ 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________ 。
(3)根据上述反应可推知__________________ 。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
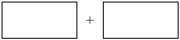
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________ 。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________ 。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为
(3)根据上述反应可推知
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)

(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式
您最近一年使用:0次
2018-10-22更新
|
739次组卷
|
6卷引用:专题2.3 氧化还原反应 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》
(已下线)专题2.3 氧化还原反应 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》山东省临沂市第十九中学2019届高三上学期第三次质量调研考试化学试题山东省济宁市嘉祥县第一中学2022届高三10月月考化学试题(已下线)第3讲 氧化还原反应2017届内蒙古杭锦后旗奋斗中学高三上第一次月考化学试卷福建省平潭县新世纪学校2020届高三上学期第一次月考化学试题
22-23高三上·山东菏泽·期末
名校
解题方法
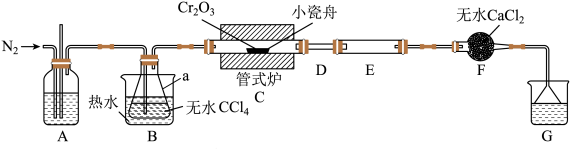
9 . 三氯化铬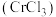 是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为
的反应为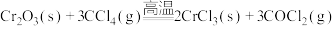 ,其实验装置(夹持仪器省略)如下图所示:
,其实验装置(夹持仪器省略)如下图所示:
已知:① (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: ;
;
②碱性条件下, 可将
可将 氧化为
氧化为 ;酸性条件下,
;酸性条件下, 将
将 还原为
还原为 。回答下列问题:
。回答下列问题:
(1)仪器a的名称是_____ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)实验过程中若D处出现堵塞,可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)装置G中的液体是足量NaOH溶液,发生反应的离子方程式为_______ 。
(4)测定产品中 质量分数的实验步骤如下:
质量分数的实验步骤如下:
I.取mg 产品,在强碱性条件下,加入过量30%
产品,在强碱性条件下,加入过量30% 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;
II.冷却后,定容于100mL容量瓶中,准确移取上述溶液10.00ml,置于锥形瓶中,加入10ml蒸馏水,2mL浓硫酸和浓磷酸混酸(加浓磷酸的目的是为了防止指示剂提前变色),2滴二苯胺磺酸(指示剂),用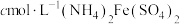 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液VmL(已知
标准溶液VmL(已知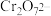 被
被 还原为
还原为 )。
)。
①产品中 质量分数表达式为
质量分数表达式为_______ 。
②下列操作将导致产品中 质量分数测定值偏高的是
质量分数测定值偏高的是_______ (填字母标号)。
a.步骤I中未继续加热一段时间
b.步骤II中未加浓磷酸
c.步骤III中所用 溶液已变质
溶液已变质
d.步骤III中达到滴定终点读数时,滴定管口有半滴悬液没有滴下
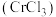 是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为
的反应为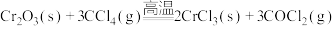 ,其实验装置(夹持仪器省略)如下图所示:
,其实验装置(夹持仪器省略)如下图所示:
已知:①
 (俗称光气)有毒,遇水发生水解:
(俗称光气)有毒,遇水发生水解: ;
;②碱性条件下,
 可将
可将 氧化为
氧化为 ;酸性条件下,
;酸性条件下, 将
将 还原为
还原为 。回答下列问题:
。回答下列问题:(1)仪器a的名称是
(2)实验过程中若D处出现堵塞,可观察到的现象是
(3)装置G中的液体是足量NaOH溶液,发生反应的离子方程式为
(4)测定产品中
 质量分数的实验步骤如下:
质量分数的实验步骤如下:I.取mg
 产品,在强碱性条件下,加入过量30%
产品,在强碱性条件下,加入过量30% 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;II.冷却后,定容于100mL容量瓶中,准确移取上述溶液10.00ml,置于锥形瓶中,加入10ml蒸馏水,2mL浓硫酸和浓磷酸混酸(加浓磷酸的目的是为了防止指示剂提前变色),2滴二苯胺磺酸(指示剂),用
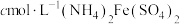 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液VmL(已知
标准溶液VmL(已知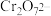 被
被 还原为
还原为 )。
)。①产品中
 质量分数表达式为
质量分数表达式为②下列操作将导致产品中
 质量分数测定值偏高的是
质量分数测定值偏高的是a.步骤I中未继续加热一段时间
b.步骤II中未加浓磷酸
c.步骤III中所用
 溶液已变质
溶液已变质d.步骤III中达到滴定终点读数时,滴定管口有半滴悬液没有滴下
您最近一年使用:0次
2023-01-16更新
|
269次组卷
|
3卷引用:山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(实验综合题)
(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(实验综合题)山东省鄄城县第一中学2022-2023学年高三上学期期末考试化学试题山东省菏泽市郓城县实验中学2022-2023学年高三上学期期末考试化学试题
2021高三·山东·专题练习
解题方法
10 . 重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。某实验小组以铬铁矿[主要成分为FeO·Cr2O3,还含有少量的MgCO3、Al2O3、SiO2等]为原料,制备K2Cr2O7,流程如图:

已知:①酸化1后的溶液中含有Na2CrO4、Na2CO3等。
②NaNO2具有还原性,当溶液酸性很强时易被强氧化剂氧化。
(1)高温氧化时发生多个反应,其中Al2O3和SiO2分别转化为NaNO2和___________ ;FeO·Cr2O3参与反应的产物中含有Fe2O3、NaNO2等,该反应化学方程式为___________ 。
(2)滤渣1的成分为___________ 。
(3)为使溶液中铝元素尽可能生成沉淀而除去,则需调节溶液中Al3+、AlO 浓度均不超过10-6 mol·L-1.为达此目的酸化1溶液的pH范围是
浓度均不超过10-6 mol·L-1.为达此目的酸化1溶液的pH范围是___________ 。已知:Al(OH)3(s)  H+(aq)+AlO-(aq)+H2O(l) K=1×10-14;Ksp[Al(OH)3]=1×10-33
H+(aq)+AlO-(aq)+H2O(l) K=1×10-14;Ksp[Al(OH)3]=1×10-33
(4)酸化2时,酸化的作用是___________ ,在酸化时溶液酸性不能太强的原因是___________ 。
(5)称取K2Cr2O7,样品2.40 g,配成250 mL溶液,取25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾,并放于暗处,约6 min后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(杂质不参与反应),共用去Na2S2O3标准溶液20.00 mL,所得样品中K2Cr2O7的质量分数为___________ 。
相关反应:(ⅰ)Cr2O +I-+H+-Cr3++I2+H2O (ⅱ)I2+2S2O
+I-+H+-Cr3++I2+H2O (ⅱ)I2+2S2O =2I-+S4O
=2I-+S4O

已知:①酸化1后的溶液中含有Na2CrO4、Na2CO3等。
②NaNO2具有还原性,当溶液酸性很强时易被强氧化剂氧化。
(1)高温氧化时发生多个反应,其中Al2O3和SiO2分别转化为NaNO2和
(2)滤渣1的成分为
(3)为使溶液中铝元素尽可能生成沉淀而除去,则需调节溶液中Al3+、AlO
 浓度均不超过10-6 mol·L-1.为达此目的酸化1溶液的pH范围是
浓度均不超过10-6 mol·L-1.为达此目的酸化1溶液的pH范围是 H+(aq)+AlO-(aq)+H2O(l) K=1×10-14;Ksp[Al(OH)3]=1×10-33
H+(aq)+AlO-(aq)+H2O(l) K=1×10-14;Ksp[Al(OH)3]=1×10-33(4)酸化2时,酸化的作用是
(5)称取K2Cr2O7,样品2.40 g,配成250 mL溶液,取25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾,并放于暗处,约6 min后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(杂质不参与反应),共用去Na2S2O3标准溶液20.00 mL,所得样品中K2Cr2O7的质量分数为
相关反应:(ⅰ)Cr2O
 +I-+H+-Cr3++I2+H2O (ⅱ)I2+2S2O
+I-+H+-Cr3++I2+H2O (ⅱ)I2+2S2O =2I-+S4O
=2I-+S4O
您最近一年使用:0次



