名校
1 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质:资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)
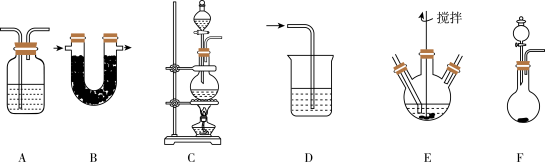
①请写出该过程中制备氯气的离子反应方程式_______ (锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_______ →E→_______ 。(上述装置不一定全部用到,装置可以重复选用)
③E中得到紫色固体和溶液。E中生成高铁酸钾的反应为_______ ;反应充分进行后,E中溶液中主要的阴离子为_______ 。
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl−而产生Cl2,设计以下方案:
①由方案Ⅰ中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl−氧化,还可能由_______ 产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是_______ 。
(1)制备K2FeO4(夹持装置略)

①请写出该过程中制备氯气的离子反应方程式
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为
③E中得到紫色固体和溶液。E中生成高铁酸钾的反应为
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl−而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
您最近一年使用:0次
2 . 研究氮及其化合物的制备性质具有重要的意义。回答下列问题:
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证 的性质。
的性质。________ ,锥形瓶中的药品是________ 。
(2)装置乙的作用是________ ;装置丙用于收集 ,应将导管
,应将导管________ (填“a”或“b”)延长至集气瓶底部。
(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为__________ ,证明氨气具有________ (填“氧化性”或“还原性”)。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是________ (填标号)。 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为_____________ 。
(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是________________ 。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证
 的性质。
的性质。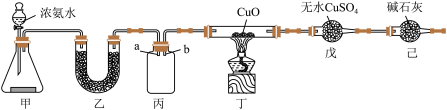
(2)装置乙的作用是
 ,应将导管
,应将导管(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是
a.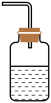 b.
b.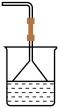 c.
c. d.
d.
 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。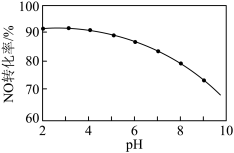
 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是
您最近一年使用:0次
2023-04-27更新
|
180次组卷
|
3卷引用:山东省临沂市五区县2022-2023学年高一下学期期中考试化学试题
解题方法
3 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是________ (填化学式),过氧化钠(Na2O2)中氧元素化合价为_____ 。(填数字)
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_________________ 。
②每生成1mol FeO42-转移___ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____ mol。
(3)配平下面化学方程式,回答下列问题:____ C +K2Cr2O7+H2SO4=K2SO4+CO2↑+Cr2(SO4)3+H2O。
①H2SO4在上述反应中表现出来的性质是(填选项编号)______ 。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____ L。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO42-转移
(3)配平下面化学方程式,回答下列问题:
①H2SO4在上述反应中表现出来的性质是(填选项编号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
解题方法
4 . 根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为__________ 。
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:__________ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:
方案一:碱性条件下用 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为__________ 。
方案二:在碱性条件下,用铝粉处理,已知反应时Al与 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是__________ ,还原产物是__________ ,请写出反应的离子方程式:__________ 。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:
(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:方案一:碱性条件下用
 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为方案二:在碱性条件下,用铝粉处理,已知反应时Al与
 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是
您最近一年使用:0次
名校
解题方法
5 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_________ (填序号)。
甲. 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_________ ;②加入_________ 。
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_________ 。
(4)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 作用,得到
作用,得到 最多的是
最多的是___________ 。
(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为 ),可用如图转化方式除去。
),可用如图转化方式除去。
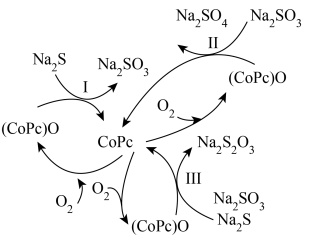
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为___________ 。
②在废水处理整个过程中,催化剂为___________ ,氧化剂为___________ 。
③反应Ⅲ中 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式_________________ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值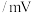 | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
甲.
 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于
 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为
 ),可用如图转化方式除去。
),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为
②在废水处理整个过程中,催化剂为
③反应Ⅲ中
 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式
您最近一年使用:0次
2023-12-04更新
|
384次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高一上学期11月期中考试化学试题
6 . 储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4) 3+8H2O。请回答下列问题:
(1)用单线桥法标明上述反应方程式中电子转移的方向和数目_______ (仅写出氧化剂和还原剂即可)。
(2)上述反应中氧化剂是_______ ,被氧化的元素是_______ (填元素符号) 。
(3)H2SO4在上述反应中表现出来的性质是_______(填标号)。
(4)请配平下列离子方程式_______ 。
_______Fe2+ + _______H+ +_______ = _______Fe3+ + _______N2O↑ + _______H2O
= _______Fe3+ + _______N2O↑ + _______H2O
(1)用单线桥法标明上述反应方程式中电子转移的方向和数目
(2)上述反应中氧化剂是
(3)H2SO4在上述反应中表现出来的性质是_______(填标号)。
| A.酸性 | B.氧化性 | C.氧化性和酸性 | D.还原性和酸性 |
_______Fe2+ + _______H+ +_______
 = _______Fe3+ + _______N2O↑ + _______H2O
= _______Fe3+ + _______N2O↑ + _______H2O
您最近一年使用:0次
解题方法
7 . (1)储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应式为:C+K2Cr2O7+H2SO4——CO2+K2SO4+Cr2(SO4)3+H2O(未配平)
①配平上述方程式_________ :
②上述反应中氧化剂是_______ (填化学式,下同),氧化产物是__________ 。
③H2SO4在上述发应中表现出来的性质是_______ (填序号)
a.氧化性 b.氧化性和酸性 c.酸性 d.还原性和酸性
(2)由下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成化学方程式并配平:_________
+ → I2 + + + H2O
②用双线桥表示该反应中电子转移的方向和数目:___________
①配平上述方程式
②上述反应中氧化剂是
③H2SO4在上述发应中表现出来的性质是
a.氧化性 b.氧化性和酸性 c.酸性 d.还原性和酸性
(2)由下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成化学方程式并配平:
+ → I2 + + + H2O
②用双线桥表示该反应中电子转移的方向和数目:
您最近一年使用:0次
8 . 铅位于IVA族,PbO偏碱性,易溶于硝酸,PbO2偏酸性,难溶于硝酸。已知:PbS与稀HNO3发生反应I :3PbS + 8HNO3(稀) =3Pb(NO3)2 +3S↓+2NO↑+4H2O;PbS与浓HNO3发生反应II:PbS +8HNO3(浓) = PbSO4+8NO2↑+4H2O。下列推断正确的是
| A.Pb3O4 与HNO3溶液发生反应:Pb3O4 +4H+= PbO2 +2Pb2+ +2H2O |
| B.由反应I、II可知,氧化性:HNO3(浓)>HNO3(稀)>PbO2 |
| C.反应I若生成4.48LNO,转移0.6NA电子 |
D.S可以与浓硝酸反应:S +6HNO3(浓) H2SO4 +6NO2↑+2H2O H2SO4 +6NO2↑+2H2O |
您最近一年使用:0次
2020-09-30更新
|
333次组卷
|
4卷引用:山东省济南市莱芜第一中学2021-2022学年高三上学期期中考试化学试题
11-12高一上·黑龙江·期中
解题方法
9 . (1)在Fe3O4 +4CO 3Fe+4CO2的反应中,
3Fe+4CO2的反应中,____________ 是氧化剂,_________________ 是还原剂,_______ 元素被氧化,_______ 元素被还原。
(2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目_________________ ,_____ Cu +___ HNO3(浓)===____ Cu(NO3)2+_____ NO2↑ +_____ H2O,浓硝酸表现出来的性质是_______________ (填写编号)。
①还原性 ②酸性 ③氧化性
 3Fe+4CO2的反应中,
3Fe+4CO2的反应中,(2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目
①还原性 ②酸性 ③氧化性
您最近一年使用:0次
名校
10 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
Ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO;
,同时生成NO;
Ⅱ.
Ⅲ. 在碱性溶液中反应生成
在碱性溶液中反应生成 和
和 。
。
(1)反应①的离子方程式___________ 。
(2)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 。
(3) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(4)写出反应②的离子反应方程式___________ 。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。若检验滤液中的
。若检验滤液中的 ,需要选择下列哪些试剂完成检验(填序号)
,需要选择下列哪些试剂完成检验(填序号)___________ 。
可供选择的试剂:①无水乙醇② ③氢氧化钠溶液④稀
③氢氧化钠溶液④稀 ⑤淀粉溶液⑥
⑤淀粉溶液⑥ 溶液。
溶液。

资料显示:
Ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO;
,同时生成NO;Ⅱ.

Ⅲ.
 在碱性溶液中反应生成
在碱性溶液中反应生成 和
和 。
。(1)反应①的离子方程式
(2)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(3)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(4)写出反应②的离子反应方程式
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。若检验滤液中的
。若检验滤液中的 ,需要选择下列哪些试剂完成检验(填序号)
,需要选择下列哪些试剂完成检验(填序号)可供选择的试剂:①无水乙醇②
 ③氢氧化钠溶液④稀
③氢氧化钠溶液④稀 ⑤淀粉溶液⑥
⑤淀粉溶液⑥ 溶液。
溶液。
您最近一年使用:0次



