名校
解题方法
1 . 锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:

查阅资料知各离子沉淀完全的pH为
已知:锌元素与铝元素相似,具有两性。
(1)市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为___________ ;电极总反应方程为___________ ;
(2)在预处理中,分离铁皮和锌皮的方法是___________ 。洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为___________ 。
(3)二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式___________ ;盐酸溶解后回收的渣是___________ ;
(4)已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是___________ ;
(5)实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为_______ :
(6)硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为___________ 。
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |

查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
(1)市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为
(2)在预处理中,分离铁皮和锌皮的方法是
(3)二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式
(4)已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是
(5)实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
(6)硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为
您最近一年使用:0次
名校
2 . 实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如图所示:回答下列问题:
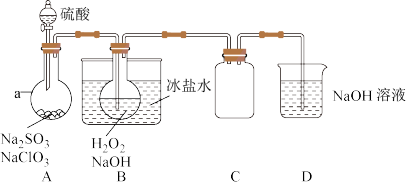
(1)仪器a的名称为___________ ;装置C的作用是___________ 。
(2)B中发生反应的化学方程式为___________ 。
(3)该实验必须使NaClO3稍微过量,目的是___________ 。
(4)证明NaClO2具有氧化性的方法是:取少量将B中溶液于试管中,先___________ ,再加入___________ (填序号,下同)酸化,最后加入___________ 检验。
①稀HNO3②稀H2SO4③K2SO3溶液④BaCl2溶液⑤FeCl2溶液⑥KSCN溶液

(1)仪器a的名称为
(2)B中发生反应的化学方程式为
(3)该实验必须使NaClO3稍微过量,目的是
(4)证明NaClO2具有氧化性的方法是:取少量将B中溶液于试管中,先
①稀HNO3②稀H2SO4③K2SO3溶液④BaCl2溶液⑤FeCl2溶液⑥KSCN溶液
您最近一年使用:0次
22-23高三上·山东烟台·期末
3 . 工业上以铬矿渣(主要成分为 ,含有少量的
,含有少量的 )制备重要化工原料重铬酸钾
)制备重要化工原料重铬酸钾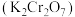 晶体的工艺流程如下:
晶体的工艺流程如下:
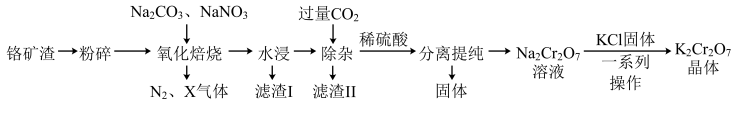
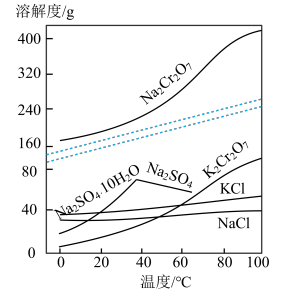
已知:①焙烧可将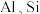 的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
回答下列问题:
(1)“氧化焙烧”时, 被氧化生成
被氧化生成 的化学方程式为
的化学方程式为_______ 。
(2)“滤渣I”、“滤渣II”的主要成分分别是_______ 、_______ (填化学式):实验室中进行“除杂”操作用到的玻璃仪器有_______ 。
(3)分离提纯后得到固体的化学式为_______ ;“一系列操作”是_______ 、过滤、洗涤、干燥,最后得到 晶体。
晶体。
(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到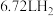 (标准状况下)时有
(标准状况下)时有_______ molCr2O 被还原,一段时间后产生
被还原,一段时间后产生 和
和 沉淀,若电解后溶液中
沉淀,若电解后溶液中 ,则
,则
_______  。(已知
。(已知 )
)

 ,含有少量的
,含有少量的 )制备重要化工原料重铬酸钾
)制备重要化工原料重铬酸钾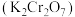 晶体的工艺流程如下:
晶体的工艺流程如下:
已知:①焙烧可将
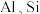 的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
回答下列问题:
(1)“氧化焙烧”时,
 被氧化生成
被氧化生成 的化学方程式为
的化学方程式为(2)“滤渣I”、“滤渣II”的主要成分分别是
(3)分离提纯后得到固体的化学式为
 晶体。
晶体。(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到
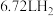 (标准状况下)时有
(标准状况下)时有 被还原,一段时间后产生
被还原,一段时间后产生 和
和 沉淀,若电解后溶液中
沉淀,若电解后溶液中 ,则
,则
 。(已知
。(已知 )
)
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 . 锰及其化合物用途广泛,以菱锰矿(主要成分为 ,还含有铁、镍、钴的碳酸盐以及
,还含有铁、镍、钴的碳酸盐以及 杂质)为原料生产金属锰和高品位
杂质)为原料生产金属锰和高品位 的工艺流程如图1所示。
的工艺流程如图1所示。

已知 时,部分物质的溶度积常数如表所示:
时,部分物质的溶度积常数如表所示:
(1)“溶浸”时,锰的浸出率与浸出时间的关系如图2所示。由图可知,所采用的最佳实验条件(温度、时间)为_______ 。

(2) 主要用于氧化
主要用于氧化_______ 。滤渣1中残余的 可加入葡萄糖-硫酸溶液处理,回收
可加入葡萄糖-硫酸溶液处理,回收 ,氧化产物为
,氧化产物为 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。
(3)滤渣3的主要成分为_______ (填化学式,其中 、
、 均为
均为 价)。
价)。
(4)“沉锰”时 除了作沉淀剂外,还有
除了作沉淀剂外,还有_______ 作用;“沉锰”的关键操作有两点:①将 溶液加入
溶液加入 溶液中;②反应终点溶液
溶液中;②反应终点溶液 。如果①中颠倒试剂滴加顺序(反应
。如果①中颠倒试剂滴加顺序(反应 大于7),可能造成的后果是
大于7),可能造成的后果是_______ ;若反应终点溶液 小于7,可能的后果是
小于7,可能的后果是_______ 。
(5)以 作电极,
作电极,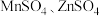 溶液为电解液,经过一系列步骤制得隐形战机涂料
溶液为电解液,经过一系列步骤制得隐形战机涂料 ,则电解时阳极生成
,则电解时阳极生成 的电极总反应式为
的电极总反应式为_______ 。
 ,还含有铁、镍、钴的碳酸盐以及
,还含有铁、镍、钴的碳酸盐以及 杂质)为原料生产金属锰和高品位
杂质)为原料生产金属锰和高品位 的工艺流程如图1所示。
的工艺流程如图1所示。
已知
 时,部分物质的溶度积常数如表所示:
时,部分物质的溶度积常数如表所示:| 物质 |  |  |  |  |  |  |  |
 | 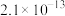 | 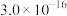 | 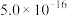 |  | 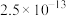 | 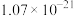 |  |

(2)
 主要用于氧化
主要用于氧化 可加入葡萄糖-硫酸溶液处理,回收
可加入葡萄糖-硫酸溶液处理,回收 ,氧化产物为
,氧化产物为 ,写出反应的离子方程式:
,写出反应的离子方程式:(3)滤渣3的主要成分为
 、
、 均为
均为 价)。
价)。(4)“沉锰”时
 除了作沉淀剂外,还有
除了作沉淀剂外,还有 溶液加入
溶液加入 溶液中;②反应终点溶液
溶液中;②反应终点溶液 。如果①中颠倒试剂滴加顺序(反应
。如果①中颠倒试剂滴加顺序(反应 大于7),可能造成的后果是
大于7),可能造成的后果是 小于7,可能的后果是
小于7,可能的后果是(5)以
 作电极,
作电极,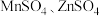 溶液为电解液,经过一系列步骤制得隐形战机涂料
溶液为电解液,经过一系列步骤制得隐形战机涂料 ,则电解时阳极生成
,则电解时阳极生成 的电极总反应式为
的电极总反应式为
您最近一年使用:0次
2023-01-14更新
|
311次组卷
|
3卷引用:广东省广州市2022届高三一模考试(工业流程题)
22-23高三上·广东茂名·阶段练习
解题方法
5 . 研究小组用氯气氧化K2MnO4制备KMnO4 (加热装置已省略),并利用产品进行实验探究。

(1)实验过程中装置连接顺序为_______ ,装置C的作用为_______ 。
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是_______ 。
②停止加热后,拆卸装置前应采取的实验操作为_______ 。
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
①实验中t1<t2,则a=_______ ,b=_______ 。
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为_______ ,历程中生成CO2的离子反应方程式为_______ 。
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为_______ (用含a、b的代数式表示)。[已知: ,
, ]
]

(1)实验过程中装置连接顺序为
(2)加热反应一段时间,观察到装置B中溶液由墨绿色变成紫红色后关闭分液漏斗活塞,停止加热,将KMnO4溶液减压过滤后,倒入蒸发皿中水浴蒸发浓缩、抽滤即得紫红色KMnO4固体。
①装置A中最合适的反应温度为80℃,需要采取的实验方法是
②停止加热后,拆卸装置前应采取的实验操作为
(3)小组用提纯后的KMnO4配成溶液与H2C2O4反应,探究H2C2O4浓度对反应速率的影响。利用下列试剂完成实验设计。提供试剂:蒸馏水,0.01 mol∙L-1 KMnO4溶液、0.2 mol∙L-1 H2C2O4溶液、0.5 mol∙L-1 H2SO4溶液
| 编号 | 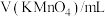 |  | 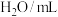 | 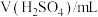 | 褪色时间/s |
| Ⅰ | 5.0 | 5.0 | 3 | 2 |  |
| Ⅱ | 5.0 | a | b | 2 |  |
②在实验中Ⅰ、Ⅱ中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后逐渐加快。某同学查阅得知,存在如下反应历程

反应一段时间后褪色速度突然加快的原因为
(4)取a g实验制得的KMnO4固体溶于水,加入过量的饱和Ba(OH)2溶液(KMnO4不参与反应)沉降
 ,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为
,离心分离,将上层清液及沉淀的洗涤液均移至容量瓶,并配成100mL溶液。取20.00mL上述溶液于碘量瓶中,加入稀硫酸、过量10% KI溶液,放置一段时间后加入几滴1%淀粉指示剂,用0.0100 mol∙L-1 Na2S2O3标准溶液滴定,重复实验3次,平均消耗标准溶液b mL,该KMnO4的纯度为 ,
, ]
]
您最近一年使用:0次
21-22高三下·广东佛山·阶段练习
名校
解题方法
6 . 近年来,研究人员提出用I—作为水溶液中SO2歧化反应的催化剂,实现含SO2工业污水的处理,其催化过程分两步完成:
i.SO2+4I—+4H+= S↓+2I2+2H2O
ii. I2+ 2H2O+SO2 = + 4H++ 2I—
+ 4H++ 2I—
为探究i、ii反应速率与 SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I2易溶解在KI溶液中)
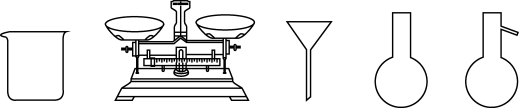
(1)KI的电子式为________ , 用KI固体配制50ml 0.4mol·L-1KI溶液,下图中的仪器需要使用到的有________ (填写名称)。
(2)实验室利用下图制备SO2气体的化学方程式为_______ 。
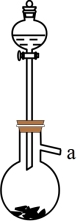
(3)水溶液中SO2歧化反应的离子方程式为________ 。
(4)实验①和②是对照实验,则a=_______ ,比较实验①和②可得出结论_______ 。
(5)实验③试剂X为________ 。比较实验②和③可知H+单独存在时不能催化SO2的歧化反应。
(6)实验表明,SO2歧化反应速率④>①,结合i和ii的反应速率,解释反应速率④>①的原因__________ 。
i.SO2+4I—+4H+= S↓+2I2+2H2O
ii. I2+ 2H2O+SO2 =
 + 4H++ 2I—
+ 4H++ 2I—为探究i、ii反应速率与 SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I2易溶解在KI溶液中)
| 序号 | ① | ② | ③ | ④ |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1KI 0.2 mol·L-1 H2SO4 | x | 0.2 mol·L-1KI 0.002 mol·L-1 I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊比①快 | 无明显现象 | 棕褐色溶液迅速褪色,变成黄色,出现浑浊比①快 |

(2)实验室利用下图制备SO2气体的化学方程式为

(3)水溶液中SO2歧化反应的离子方程式为
(4)实验①和②是对照实验,则a=
(5)实验③试剂X为
(6)实验表明,SO2歧化反应速率④>①,结合i和ii的反应速率,解释反应速率④>①的原因
您最近一年使用:0次
2022·广东广州·一模
7 . 锑(Sb)可用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3,还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如下:
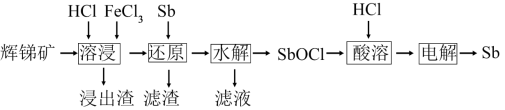
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为___________ 。
(2)“还原”时加入Sb的目的是将___________ 还原,提高产物的纯度。
(3)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为___________ 。
②下列能促进该水解反应的措施有___________ (填字母)。
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于___________ mol·L-1。
(4)“滤液”中含有的金属阳离子有___________ 。向“滤液”中通入足量___________ (填化学式)气体,再将滤液pH调至3.5,可析出Fe(OH)3沉淀。将沉淀溶于浓盐酸后,产物可返回___________ 工序循环使用。
(5)Sb可由SbCl 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为___________ 。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 2.2 | 3.7 | 7.5 | 9.6 |
| 完全沉淀时(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为
(2)“还原”时加入Sb的目的是将
(3)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为
②下列能促进该水解反应的措施有
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于
(4)“滤液”中含有的金属阳离子有
(5)Sb可由SbCl
 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近一年使用:0次
2022-03-17更新
|
1530次组卷
|
4卷引用:广东省广州市2022届高三一模考试(工业流程题)
名校
8 . 由Ca3(PO4)2、SiO2、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
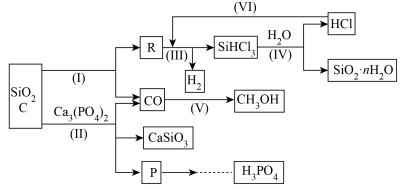
(1)上述反应中,属于置换反应的是___ [选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]。
(2)高温下进行的反应Ⅱ的化学方程式为________________________ ;固体废弃物CaSiO3可用于_________________ 。(答一条即可)
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是________________________ 。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为________ 。
(5)指出(VI)这一环节在工业生产上的意义_______________ 。
(6)写出由P→H3PO4的有关反应式:
①__________ 。 ②________________________ 。

(1)上述反应中,属于置换反应的是
(2)高温下进行的反应Ⅱ的化学方程式为
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为
(5)指出(VI)这一环节在工业生产上的意义
(6)写出由P→H3PO4的有关反应式:
①
您最近一年使用:0次
2016-12-09更新
|
396次组卷
|
7卷引用:广东省广州市第二中学2023届高三(元素与化合物)测试题
广东省广州市第二中学2023届高三(元素与化合物)测试题(已下线)2014届吉林省九校联合体高三第二次摸底考试理综化学试卷(已下线)2014届河北省唐山一中第二学期高三调研考试理综化学试卷2016届黑龙江省哈尔滨六中高三下开学考理综化学试卷2016届吉林省长春十一高三下考前冲刺二理综化学试卷2016届湖北省沙市中学高三高考前最后一卷理综化学试卷2016届吉林省长春十一高三下考前冲刺理综化学试卷二



