1 . I.化学兴趣小组对以下实验进行探究:
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式______ 。
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移______ mol电子。
(3)下列有关Fe2+的说法不正确的是_______ (选填序号)。
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是_______ (选填序号)。
(5)稀溴水的颜色为_______ 。
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式_______ 。另将Fe2+逐滴滴加到另一份稀溴水溶液中,加入几滴______ 溶液,溶液变为红色,证明Br2能将Fe2+氧化为Fe3+。
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为______ mol/L。
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移
(3)下列有关Fe2+的说法不正确的是
| A.可以先加KSCN溶液再加氯水来检验Fe2+ |
| B.可以先加铁粉再加KSCN溶液来检验Fe2+ |
| C.能使酸性KMnO4溶液紫色褪去 |
| D.能观察到溶液颜色为浅绿色 |
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是
| A.它们的原子核外电子层数随核电荷数的增加而增多 |
| B.单质(F2、Cl2、Br2、I2)的氧化性随核电荷数的增加而减弱 |
| C.被其他卤素单质从卤化物中置换出来的可能性随原子序数的增加而增大 |
| D.它们的氢化物的稳定性随原子序数的增加而增强 |
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为
您最近一年使用:0次
2 . 回答下列问题
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为_______ 。
(2)X与Z反应中氧化剂与还原剂的物质的量之比为_______ 。
(3) 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为_______ 。
(4)铜和M的浓溶液反应生成Z的化学方程式为_______ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是_______ 。
(Ⅱ)氮氧化物( )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式_______ 。
方案2:
在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
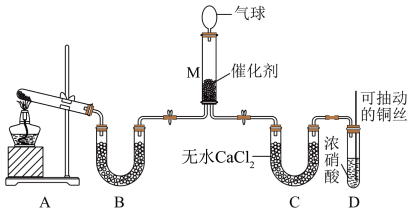
(6)用装置A制备 ,反应的化学方程式为
,反应的化学方程式为_______ ;装置B内的试剂是_______ 。
(7)装置D中发生反应的离子方程式是_______ ;可抽动铜丝的优点是_______ 。
(8)在装置M中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为_______ 。
方案3:
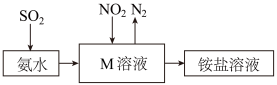
(9)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是_______ 。
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为
(2)X与Z反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为(4)铜和M的浓溶液反应生成Z的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(Ⅱ)氮氧化物(
 )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式
方案2:
在一定条件下
 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
(6)用装置A制备
 ,反应的化学方程式为
,反应的化学方程式为(7)装置D中发生反应的离子方程式是
(8)在装置M中
 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为方案3:
(9)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是
您最近一年使用:0次
名校
3 . I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是_______ (填序号),可作为证据的实验现象是_______ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO_______ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为_______ mol。
II.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(3)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是_______ (填化学式)。
(4)写出“还原”反应的化学方程式_______ 。
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______(填字母)。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(3)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(4)写出“还原”反应的化学方程式
(5)Na2S2O3是重要的化工原料,从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______(填字母)。
| A.Na2S+S | B.Na2SO3+S | C.SO2+Na2SO4 | D.Na2SO3+Na2SO4 |
您最近一年使用:0次
名校
4 . 电子工业常用30%的 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中 存在的试剂是
存在的试剂是_______ ,证明 存在的现象是
存在的现象是_______ 。
(2)写出 溶液与金属铜发生反应的离子方程式
溶液与金属铜发生反应的离子方程式_______ 。
(3)某工程师为了从使用过的腐蚀废液(主要含 、
、 、
、 、
、 )中回收铜,并重新获得纯净的
)中回收铜,并重新获得纯净的 溶液,准备采用图示步骤。
溶液,准备采用图示步骤。
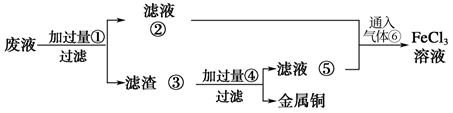
请写出上述实验中加入或生成的有关物质的化学式:①_______ ,④_______ 。
(4)将铜片放入
 溶液中,反应一段时间后取出铜片,溶液中
溶液中,反应一段时间后取出铜片,溶液中 ,则此时溶液中的
,则此时溶液中的 与
与 的物质的量之比为
的物质的量之比为_______ 。
 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。(1)检验溶液中
 存在的试剂是
存在的试剂是 存在的现象是
存在的现象是(2)写出
 溶液与金属铜发生反应的离子方程式
溶液与金属铜发生反应的离子方程式(3)某工程师为了从使用过的腐蚀废液(主要含
 、
、 、
、 、
、 )中回收铜,并重新获得纯净的
)中回收铜,并重新获得纯净的 溶液,准备采用图示步骤。
溶液,准备采用图示步骤。
请写出上述实验中加入或生成的有关物质的化学式:①
(4)将铜片放入

 溶液中,反应一段时间后取出铜片,溶液中
溶液中,反应一段时间后取出铜片,溶液中 ,则此时溶液中的
,则此时溶液中的 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2021-11-11更新
|
475次组卷
|
2卷引用:天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题
5 . 焦亚硫酸钠(Na2S2O5) 是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3 转化为Na2S2O5。完成下列填空:
(1) 碳原子的原子结构示意图是_____________ ;CO2的化学键类型_______________________ 。
(2) 从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________ 。
(3)SO2 与Na2CO3 溶液反应生成NaHSO3 和CO2 ,其化学方程式为_____________________ ,证明NaHSO3 溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________________ 。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+ H2O→Na2SO4+ H2SO4,该反应中,氧化产物是_____ ;若反应中转移了0.04 mol 的电子,有____ g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4 酸性溶液发生反应:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL 该溶液于锥形瓶中,用0.1000mol/L的KMnO4 溶液滴定。重复上述操作2 次,平均消耗KMnO4 溶液21.00mL。则该样品中Na2S2O4的质量分数为________ (杂质不参与反应)。(保留至0.1%)
(1) 碳原子的原子结构示意图是
(2) 从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。
(3)SO2 与Na2CO3 溶液反应生成NaHSO3 和CO2 ,其化学方程式为
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+ H2O→Na2SO4+ H2SO4,该反应中,氧化产物是
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4 酸性溶液发生反应:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL 该溶液于锥形瓶中,用0.1000mol/L的KMnO4 溶液滴定。重复上述操作2 次,平均消耗KMnO4 溶液21.00mL。则该样品中Na2S2O4的质量分数为
您最近一年使用:0次



